Клинический случай рак желудка
По материалам:A multidisciplinary approach to an unusual medical case of locally advanced gastric cancer: a case report
Nicola Carlomagno, Fabrizio Schonauer, Vincenzo Tammaro, Annalena Di Martino, Carmen Criscitiello, Michele L. Santangelo
Journal of Medical Case Reports 2015, 9:13
81‑летняя женщина поступила в терапевтическое отделение с жалобами на общую слабость, потерю веса, рвоту и боли в животе. В анамнезе: гипертоническая болезнь и холецистэктомия по поводу острого холецистита. При осмотре обнаружена припухлость на передней брюшной стенке, высказано предположение о послеоперационной грыже. Однако при эндоскопическом исследовании выявлена опухоль антрального отдела желудка. В следующие несколько дней над описанной припухлостью образовалась сначала небольшая кожная язва, а затем сформировался свищ. Пациентка была переведена в хирургическое отделение.

Для справки
Пан-цитокератин (общий цитокератин, цитокератин АЕ1/АЕ3) — смесь моноклональных антител к различным цитокератинам, белкам цитоскелета эпителиальных клеток. Используется для дифференциальной диагностики рака и неэпителиальных опухолей.
Хромогранин А содержится в гранулах большинства нейроэндокринных клеток. Специфичный маркер нейроэндокринных опухолей разного происхождения.
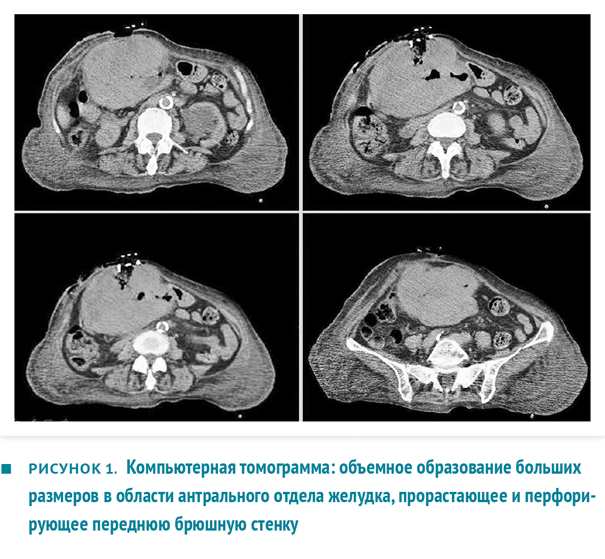
При лабораторном исследовании выявлены гипопротеинемия 46 г/л, гипоальбуминемия 20 г/л и анемия (гемоглобин 83 г/л). При выполнении компьютерной томографии (КТ) описано массивное образование 10×14×15 см в области антрума с центральным некрозом и кровоизлияниями, со слабой васкуляризацией, без четкой границы с левой долей печени (рис. 1). Опухолевая масса врастала в поперечную ободочную кишку и прямую мышцу живота, занимала значительную часть верхнего этажа брюшной полости и формировала наружный свищ. При КТ-исследовании не обнаружено метастазов.
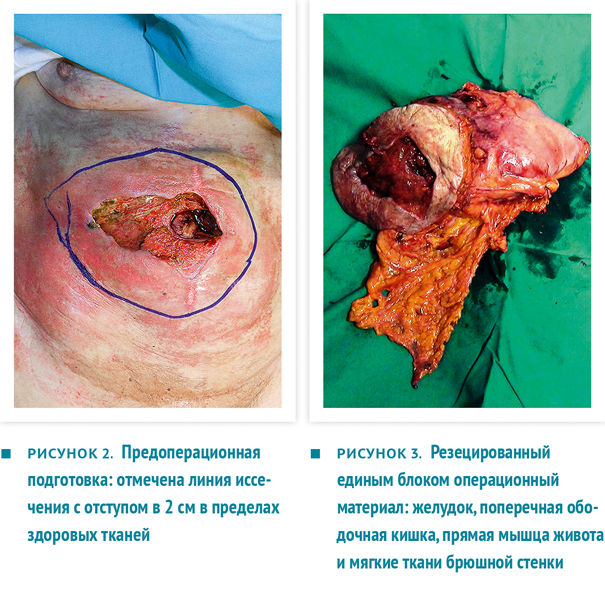
Проведено хирургическое лечение. Вокруг неопластического поражения выполнен эллиптический разрез в пределах 2 см здоровых тканей (рис. 2). Боковые края расширены линейными разрезами.
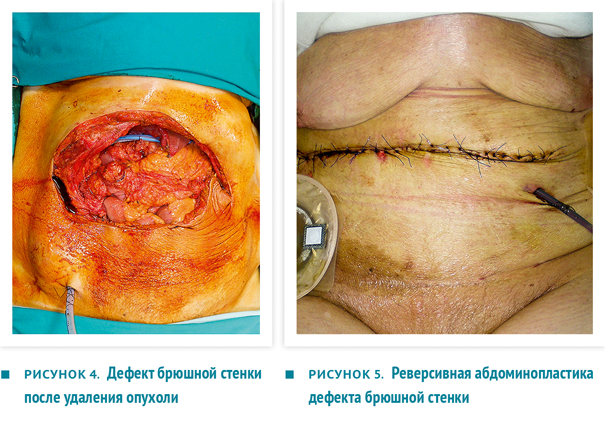
Единым блоком резецированы участок передней брюшной стенки, часть желудка и часть ободочной кишки (рис. 3), проведена систематическая лимфодиссекция, после чего наложен аппаратный гастроеюноанастомоз и ручной тонко-толстокишечный анастомоз. Установлены 2 внутрибрюшных дренажа (рис. 4).
Дефект передней брюшной стенки протезирован сетчатым трансплантатом, рана закрыта методом реверсивной абдоминопластики (рис. 5). Внутрибрюшное давление в ходе оперативного вмешательства и в послеоперационном периоде было
ниже 10 мм. рт. ст.
Для справки
CD56 — молекула клеточной адгезии, в норме экспрессируется на поверхности натуральных киллеров, нейронов, клеток глии, скелетных мышц. Определяется на клетках многих солидных и гематологических опухолей.
Виментин — белок цитоскелета клеток мезодермального происхождения, в частности соединительной ткани. Обнаруживают при фиброзных опухолях, саркомах, мезотелиоме.
Синаптофизин участвует в формировании синаптических пузырьков в нервных клетках. Маркер нейроэндокринных опухолей.
Белок S-100 — семейство кальций-связывающих белков, повышение концентрации наблюдается при прогрессии меланомы.
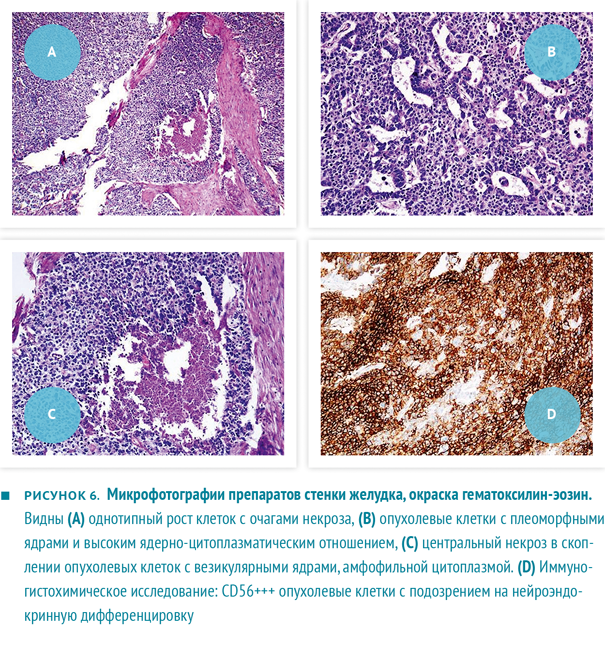
По данным гистологического исследования, удаленная опухоль соответствовала малодифференцированной аденокарциноме с чертами нейроэндокринной дифференцировки с прорастанием до слизистой оболочки поперечной ободочной кишки и мягких тканей до кожи (рис. 6а‑с). При иммуногистохимическом исследовании выявлено позитивное окрашивание к пан-цитокератину, хромогранину и CD56 (рис. 6d), негативное — к виментину, синаптофизину и S-100.
Состояние пациентки в раннем послеоперационном периоде было удовлетворительным. По поводу анемии легкой степени проведены гемотрансфузии в первые 3 дня. Активная перистальтика отмечена с 3‑го дня. С 6-го дня, после контрастного рентгенологического исследования верхних отделов ЖКТ, пациентка начала самостоятельно принимать пищу.
К сожалению, с 10‑го дня у пациентки на фоне пневмонии развился тяжелый респираторный дистресс-синдром. Несмотря на проводимую антибактериальную терапию и перевод в отделение интенсивной терапии, она умерла на 20‑й день после операции.
Обсуждение
Несмотря на то что рак желудка часто обнаруживают только на поздних стадиях [1, 2], прорастание опухолью брюшной стенки с ее деструкцией и формированием наружного желудочного свища встречается редко. Обычно поражение опухолевыми клетками ограничивается серозными оболочками и прилежащими тканями смежных органов [3]. В литературе описаны единичные случаи серьезного поражения кишечника при раке желудка и манифестации болезни с кишечной непроходимости [4–7], прямокишечного кровотечения, запоров и тенезмов [8]. Еще более редки случаи доминирования симптомов массивного прорастания брюшной стенки. Описан 62‑летний пациент с диффузной инвазией опухолевых клеток в переднюю брюшную стенку при раке желудка, однако без ее полного разрушения [9].
Ранее опубликованы случаи гастроинтестинальных стромальных опухолей желудка, достигавших гигантских размеров и отличавшихся быстрым ростом по сравнению со «средними» аденокарциномами [10, 11], но в данном случае описан ранее не представленный тип этой опухоли — нейроэндокринный.
Публикация клинического случая и сопутствующих иллюстраций осуществлялись с одобрения родственников пациентки. Копия подписанного информированного согласия находится у главного редактора журнала «Journal of medical case reports».
В запущенных случаях рака желудка возможности терапии обычно ограничены неоадъювантной химиотерапией с гастростомией или еюностомией. В описанном случае подобная тактика была неприменима из‑за обширного дефекта брюшной стенки и вовлечения поперечной ободочной кишки. Было принято решение о резекции всех пораженных органов единым блоком.
При онкологических операциях во избежание контаминации опухолевыми клетками распространено широкое иссечение больших участков мягких тканей. Устранение кожного дефекта после оперативных вмешательств возможно пластикой на питающей ножке местными и отдаленными тканями, либо с переносом свободного кожного лоскута [1]. Для реконструкции дефекта верхней части передней брюшной стенки могут быть использованы кожно-мышечные лоскуты на основе прямой мышцы живота или широчайшей мышцы спины. При значительном поражении местных тканей может потребоваться свободная кожная пластика. Ее преимущество — лучший косметический эффект, а недостатки — более длительное время операции, возможность отторжения трансплантированного лоскута и большие повреждения донорского участка.
Альтернативой перечисленным методам может быть использованная в описанном случае реверсивная абдоминопластика [12]. Кожу нижнего края операционной раны вместе с поверхностной фасцией отделяют от мышечного футляра. Разрез продолжают до лобковой области, полученный лоскут подтягивают кверху для закрытия дефекта брюшной стенки. Реверсивная абдоминопластика чаще используется в пластической хирургии для коррекции формы живота после значительной потери веса [13, 14] и редко — для реконструктивных операций после резекции опухоли [15–17]. Она может быть использована в комбинации с другими типами лоскутов, а также для покрытия сетчатого эндопротеза.
Стоит отметить особо, что смерть пациентки наступила не из‑за хирургических осложнений. Внутрипузырное измерение внутрибрюшного давления рутинно проводили на всех этапах терапии, наиболее угрожаемых по развитию внутрибрюшной гипертензии и абдоминального компартмент-синдрома. Оперативное вмешательство проведено усилиями хирурга-онколога и пластического хирурга с применением адекватной техники. Авторы статьи убеждены в пользе и важности индивидуального подхода и нестандартных решений в сложных случаях хирургического вмешательства при онкологических заболеваниях.
Список источников
- Santangelo M, et al. Extended total gastrectomy: indications in the 3rd millennium. Minerva Chir. 2001;56 (1):1–6.
- Tammaro V, et al. Prognostic value of splenectomy and lymph-node dissection during gastric cancer resection. Chir Ital. 2006;58 (2):163–70.
- Feczko PJ, et al. Metastatic disease involving the gastrointestinal tract. Radiol Clin North Am. 1993;31:1359–73.
- Tomikashi K, et al. Gastric cancer metastatic to the colon. Gastrointest Endosc. 2002;55:561.
- Kumagai K, et al. Octreotide acetate successfully treated a bowel obstruction caused by peritoneally disseminated gastric cancer, thereby enabling the subsequent use of oral S-1 chemotherapy. Int J Clin Oncol. 2009;14:372–5.
- Fukuda Y, et al. A case of advanced gastric cancer with direct invasion of the transverse colon responding to paclitaxel/5′-DFUR combined therapy. Gan To Kagaku Ryoho. 2005;32:1945–8.
- Yu X, Zhang J. Gastric cancer with large bowel obstruction as the first presentation: a case report. Oncol Lett. 2013;6:1377–9.
- Alegre R, et al. Gastric cancer: an unusual presentation. Acta Gastroenterol Latinoam. 2003;33 (1):29–32.
- Waguri N, et al. A case of gastric cancer with abdominal wall invasion treated by weekly low-dose paclitaxel therapy. Gan To Kagaku Ryoho. 2006;33 (8):1151–4.
- Aomatsu N, et al. A case of emergency resection of a giant gastrointestinal stromal tumor of the stomach associated with hemorrhagic shock. Gan To Kagaku Ryoho. 2013;40 (12):2185–7.
- Okada K, et al. A case of gastrointestinal stromal tumor of the stomach with rapid growth in a short term. Gan To Kagaku Ryoho. 2008;35 (12):2080–2.
- Halbesma GJ, van der Lei B. The reverse abdominoplasty: a report of seven cases and a review of English-language literature. Ann Plast Surg. 2008;61:133–7.
- Akbas H, et al. The combined use of classic and reverse abdominoplasty on the same patient. Plast Reconstr Surg. 2002;109:2595–6.
- Hurwitz DJ. Single-staged total body lift after massive weight loss. Ann Plast Surg. 2004;52:435–41.
- Pantelides NM, et al. Reverse abdominoplasty: a practical option for oncological trunk reconstruction. Eplasty. 2013;13: e2.
- Bury TF, et al. Closure of massive chest wall defects after full-thickness chest wall resection. Ann Plast Surg. 1995;34:409–14.
- Dagregorio G, Darsonval V. Aesthetic surgery techniques after excision of dermatofibrosarcoma protuberans: a case report. Br J Plast Surg. 2005;58:556–60.
Источник
И.В. ЕГОРОВ, врач высшей категории, кандидат медицинских наук ММА им. И.М. Сеченова
Во всем мире карцинома желудка является одной из самых частых причин смерти от злокачественных заболеваний. Этот факт фиксировался в отчетах ВОЗ более четверти века назад, с его печальным постоянством встречаемся мы и сегодня. Поэтому настороженность врачей в отношении данного заболевания достаточно высокая. Впрочем, диагностика его на ранних стадиях все равно остается низкой, причем не только в РФ, где система диспансеризации пришла в состояние упадка и работа с группами риска по скрининговому эндоскопическому обследованию практически не проводится, но и за рубежом.
В итоге минимальная симптоматика или ее полное отсутствие в потенциально курабельном периоде болезни приводят к тому, что больные обращаются к врачу слишком поздно. Однако с несвоевременным установлением этого грозного диагноза, как это ни странно, вполне «благополучно» сосуществует ситуация обратная, зачастую не менее драматичная — гипердиагностика рака желудка.
Приведем два случая:
Первый случай
Больная З., 47 лет. Поступила 05.03.01?г. Выписана 23.03.01 г.
На протяжении 2 месяцев испытывает нарастающий дискомфорт в животе (без уточнения точной локализации), жидкий стул до 5—6 раз в день, появление болезненных язвочек и сухость во рту, ломкость ногтей, боль в крупных суставах, припухание правого коленного сустава, усиливающуюся слабость. Больная, с ее слов, страдает хроническим гастритом. Стал заметно снижаться аппетит, начала худеть.
При обращении в поликлинику осмотрена терапевтом. От предложенной эзофагогастродуоденоскопии (ЭГДС) отказалась, ссылаясь на повышенный рвотный рефлекс. Проведена рентгенография желудка (01.03.01), при которой, со слов больной, выявлена язва желудка, в связи с чем она и госпитализирована. В амбулаторной карте, доставленной мужем пациентки, приводится описание снимков: «Желудок до исследования содержит немного жидкости. Газовый пузырь прозрачен. Складки слизистой расширены в верхней части тела, в остальных отделах обычного калибра. На задней стенке средней части желудка отмечаются два неправильной формы округлых дефекта наполнения диаметром около 1,5?см с четкими очертаниями, соединяющихся между собой. В центре одного из них неинтенсивное депо бариевой взвеси диаметром около 3 мм. Контуры туго заполненного желудка ровные, четкие, стенки его везде эластичны, симметричны и глубоко перистальтируют. Начальная эвакуация своевременна. Луковица и петля 12-перстной кишки (ДПК) без особенностей.
ЗАКЛЮЧЕНИЕ: Рентгенологическая картина соответствует небольшому опухолевому образованию желудка с изъязвлением.
Больная направляется на госпитализацию с диагнозом «рак желудка I ст.» для дообследования и решения вопроса о дальнейшей лечебной тактике.
Объективные данные. Состояние средней тяжести. Температура тела 36,5 ?С. Нормостеник. Астенизирована. Мышечный тонус и кожный тургор несколько снижены. Кожные покровы сухие, бледные. Видимые слизистые бледные. На твердом небе и нижней десне справа одиночные афты. Отеков нет. Периферические лимфоузлы не увеличены. Правый коленный сустав дефигурирован за счет умеренной экссудации; объем активных и пассивных движений в нем снижен из-за болезненности. Перкуторный звук над грудной клеткой легочный, в нижнезадних и нижнебоковых отделах приобретает коробочный оттенок. Дыхание везикулярное с несильным ослаблением ниже углов лопаток. Хрипов нет. Частота дыхательных движений 18 в минуту. Границы сердца перкуторно не смещены. Тоны сердца несколько приглушены, короткий мягкий систолический шум над верхушкой. Ритм правильный, пульс 84 ударов в минуту. Артериальное давление 120/70 мм рт. ст. Живот в целом мягкий, вздут. Определяется умеренная болезненность по ходу нисходящего и сигмовидного отделов толстой кишки, выраженная болезненность в эпигастрии. Перистальтика выслушивается. Печень не увеличена, слабо болезненна при пальпации. Симптом Ортнера слабо положительный. Симптом поколачивания отрицательный с обеих сторон. Мочеиспускание свободное, не учащено.
ПРЕДВАРИТЕЛЬНЫЙ ДИАГНОЗ:
Рак желудка;
Раковое истощение;
Анемия.
До проведения обследования от назначения лекарственной терапии решено было воздержаться.
В анализе крови (06.03.) гемоглобин 98?г/л, лейкоциты 12,7?109/л (палочкоядерные нейтрофилы 3%, сегментоядерные нейтрофилы 72%, эозинофилы 4%, лимфоциты 17%, моноциты 4%), тромбоциты 235?109/л, СОЭ 64 мм/ч. В анализе мочи отклонений от нормы не выявлено. В биохимическом исследовании крови (06.03.) определяется значительное увеличение показателей тимоловой пробы (18,2 Ед) и гепатоцеллюлярных ферментов (аспарагиновая трансаминаза — 114?Е/л, аланиновая трансаминаза?— 108?Е/л, гамма-глутаминтранспептидаза — 212 Е/л), снижение уровня сывороточного железа (6,3?мкмоль/л); остальные показатели?— в пределах нормы. В анализе кала (06.03.) выявлено большое количество исчерченных мышечных волокон, жировых капель, крахмала; яйца гельминтов не обнаружены. С пациенткой была проведена беседа о необходимости проведения ЭГДС. Она дала согласие на исследование.
По данным ЭГДС (06.03.): пищевод и розетка кардии не изменены. В желудке умеренное количество слизи. Слизистая бледно-розовая, с очаговой атрофией в области дна. В верхней трети желудка по задней стенке две «площадки» инфильтрированной слизистой до 1 и 2,5 см в диаметре (взят материал для биопсии). Складки средней величины, стенки эластичные. Угол желудка не деформирован. Привратник проходим свободно. Луковица ДПК и постбульбарный отделы без особенностей.
ЗАКЛЮЧЕНИЕ: Картина начальных стадий атрофического гастрита. Нельзя исключить наличие опухоли тела желудка.
На следующий день проведено ультразвуковое исследование органов брюшной полости, обнаружившее диффузные изменения в паренхиме печени.
При рентгенографии органов грудной клетки (07.06.) явления умеренного пневмосклероза. Очаговых и инфильтративных теней не обнаружено. Органы средостения — без особенностей.
Гистологическое исследование: участки слизистой желудка содержат эпителиоидно-клеточные гранулемы с немногочисленными гигантскими клетками Пирогова—Лангханса. Вокруг гранулем зона выраженной перифокальной гранулоцитарной инфильтрации.
ЗАКЛЮЧЕНИЕ: Формирующийся гранулематоз слизистой желудка.
Обнаружение гранулематозного гастрита требовало обязательного проведения колоноскопии, которая была предпринята днем позже. Согласно полученному протоколу (08.03.) слизистая оболочка толстой кишки имела характерный вид «булыжной мостовой». В нисходящем и сигмовидном отделах визуализировалось множество поверхностных и более глубоких язвочек афтозного типа. При исследовании биоптатов среди участков малоизмененной ткани обнаружены явления отека и массивной нейтрофильной инфильтрации слизистой, микроабсцессы крипт, эпителиоидно-клеточные гранулемы.
По клиническим, инструментально-лабораторным и патоморфологическим данным не оставалось сомнений в диагнозе больной.
ДИАГНОЗ КЛИНИЧЕСКИЙ ЗАКЛЮЧИТЕЛЬНЫЙ:
основной: Болезнь Крона, хроническое течение с вовлечением желудка и толстой кишки;
осложнение основного диагноза: Интоксикационный и анемический синдромы.
Поливитаминная недостаточность
Больной была назначена соответствующая терапия. Состояние несколько улучшилось буквально через несколько дней: уменьшились боли в животе, стал реже стул, регрессировали явления гонартрита, улучшились показатели красной крови; пациентка активизировалась. В дальнейшем самочувствие продолжало медленно улучшаться и больная была выписана в относительно удовлетворительном состоянии.
Выявление гранулематозного гастрита — ситуация чрезвычайно редкая. Но еще реже встречается изолированное гранулематозное поражение желудка. Как правило, аналогичные морфологические изменения должны встречаться в других органах. В дифференциально-диагностический круг включены туберкулез, гистоплазмоз, бериллиоз, реакции на инородные тела. Но на первом месте оказываются саркоидоз и болезнь Крона. Диагноз, разумеется, устанавливается только морфологически.
Саркоидоз — системное гранулематозное заболевание неизвестной этиологии, характеризующееся иммунологическими нарушениями с накоплением активированных лимфоцитов и макрофагов в органах и тканях. Наиболее частой локализацией процесса являются внутригрудные лимфоузлы и легкие. Желудочно-кишечный тракт (ЖКТ) вовлекается крайне редко и всегда вторично после поражения дыхательной системы. В нашем случае рентгенограмма не обнаружила каких-либо подозрительных изменений со стороны легких и средостения.
При болезни Крона не так редко, кроме дистальных отделов подвздошной кишки, в процесс включаются другие отделы ЖКТ: в первую очередь толстая кишка, а затем желудок. Развивающиеся гранулемы в желудке рентгенологически и эндоскопически визуализируются как инфильтративная опухоль небольших размеров, что не раз становилось причиной проведения неоправданной резекции желудка. Поэтому для подтверждения диагноза проведение обследования кишечника представлялось необходимым. После изучения биоптатов стали понятными многочисленные жалобы больной.
Второй случай
Больной Ж., 57 лет. Поступил 11.04.00 г. в 17.05. Умер 13.04.00 г. в 4.10.
Сбор анамнеза затруднен из-за тяжести состояния и сниженного интеллекта больного. Беспокоят кашель и боль в области желудка. За последний год сильно похудел, аппетита практически нет, испытывает отвращение к мясной пище, часто «отрыжка тухлым». Практически не лечился. Назвать перенесенные заболевания затрудняется. Дважды отбывал уголовное наказание в местах лишения свободы. Злоупотребляет алкоголем.
Объективные данные: состояние тяжелое. Температура тела 37,3 ?С. Кожные покровы и слизистые оболочки бледные с иктерическим оттенком. Кахектичен. Сознание ясное, ориентирован в месте и времени, но несколько заторможен. Лимфоузлы не увеличены. Отеков нет. Над грудной клеткой коробочный перкуторный звук. Дыхание жесткое в межлопаточном отделе, в нижних отделах с обеих сторон — ослабленное везикулярное. Хрипов нет. Частота дыхательных движений 20 в минуту. Во время осмотра — отрывистое покашливание. Тоны сердца звучные, над верхушкой негромкий пансистолический шум, ритм правильный, частота сердечных сокращений 88—90 в минуту. Артериальное давление 115/70 мм рт. ст. Живот мягкий, болезненный в эпигастрии и мезогастрии, где хорошо (в силу общего истощения) пальпируется большая кривизна плотного смещаемого желудка. Печень на 4 см выступает из-под края реберной дуги, край плотный, ровный, слабо болезненный. Симптом Ортнера положительный. Перистальтика выслушивается. Симптом поколачивания отрицательный. Дизурии нет.
В анализе крови (11.04.), взятом cito, гемоглобин 72 г/л, лейкоциты 15,3?109/л (сегментоядерные нейтрофилы 43%, эозинофилы 2%, лимфоциты 48%, моноциты 7%), токсигенная зернистость лейкоцитов, СОЭ 58 мм/ч.
При рентгенографии органов грудной клетки (12.04.) выявлен синдром тотальной диссеминации с явлениями незначительной инфильтрации в верхушках обоих легких. По заключению специалиста, рентгенологическая картина соответствовала милиарному туберкулезу легких.
Рентгенография желудка (12.04.): Пищевод и кардия свободно проходимы, не изменены. Вдоль всей большой кривизны желудка по передней и задней стенкам определяется обширный дефект наполнения с неровной (бугристой) поверхностью. Стенки желудка на уровне дефекта ригидны. При пальпации желудок смещаем, вялая перистальтика наблюдается только в интактных частях желудка. В антральном отделе по передней стенке имеется депо бария — язвенная ниша до 2 см в диаметре с приподнятыми краями. Луковица и петля ДПК не изменены.
ЗАКЛЮЧЕНИЕ: Рентгенологическая картина соответствует экзофитно-инфильтративному раку желудка с изъязвлением.
Учитывая выявление сочетанной патологии, больной готовился к переводу в туберкулезную больницу после консультации фтизиатра. Была назначена симптоматическая терапия. Однако ночью внезапно возникло обильное желудочное кровотечение, проявившееся меленой, и больной в течение 15?минут скончался.
ДИАГНОЗ КЛИНИЧЕСКИЙ ЗАКЛЮЧИТЕЛЬНЫЙ:
основной: Рак желудка IV стадии с изъязвлением;
осложнение основного: Раковая интоксикация. Кахексия. Железодефицитная анемия. Желудочное кровотечение от 14.04.00 г.;
сопутствующие: Милиарный туберкулез легких. Хронический обструктивный бронхит, стадия ремиссии. Эмфизема легких. ДН II ст. Хронический алкоголизм.
На вскрытии, кроме поражения легких, обнаружены множественные милиарные туберкулы слизистой желудка в сочетании с солитарными туберкулами в разных стадиях казеозного распада и две туберкулезные язвы желудка, одна из которых на своем дне имела аррозированную артерию. Подслизистый слой вдоль большой кривизны, где отмечались наибольшие специфические изменения, отечен и инфильтрирован нейтрофилами и лимфоцитами, среди которых обнаруживаются эпителиоидные клетки и гигантские клетки Пирогова—Лангханса. Также выявлен творожистый некроз в регионарных по отношению к желудку лимфоузлах.
В приведенном наблюдении рентгенологическая и клиническая картина настолько соответствовала карциноме желудка, что клиницисты даже не предположили возможную связь гастральной патологии с впервые выявленным туберкулезом…
Как и всегда, при анализе врачебной ошибки, встает вопрос, можно ли было при жизни пациента поставить верный диагноз. И ответ скорее неутешительный. Причем дело не только в том, что больной находился в стационаре чуть больше суток. И не в том, что немногочисленные анамнестические данные, habitus и инструментальная характеристика закономерно и однозначно подводили врача именно к этому, впоследствии оказавшемуся неправильным заключению. Основная причина в исключительной редкости туберкулеза желудка, с одной стороны, и его классических «псевдоопухолевых» проявлениях — с другой.
Первое описание туберкулеза желудка дано Barkhausen в 1824 г., еще до открытия Р. Кохом туберкулезной палочки. В течение последующего века количество таких наблюдений неуклонно росло: в 1933 г. Benjamin собрал в мировой литературе 225 случаев. Однако в последнее время такая локализация туберкулеза почти не встречается. Во всяком случае, в российской медицинской периодике за 10 лет мы не нашли подобных сообщений. Хорошо известны предпосылки куда более редкого поражения желудка в сравнении с кишечником: малочисленность лимфатических фолликулов в стенке желудка, резистентность неповрежденной слизистой к инфекции, отчасти бактерицидность соляной кислоты и защитные свойства мукозного слоя. «Отчасти», поскольку чаще инфицирование происходит гематогенно, а не в результате заглатывания возбудителя с мокротой.
Обычно туберкулез желудка протекает в виде устойчивой к стандартному лечению хронической язвы, медленно расползающейся и редко вовлекающей мышечный слой. На этом этапе часто возникает суждение об онкологическом процессе. Также с равной частотой описывают развитие милиарных или солитарных туберкул и гиперпластические формы поражения. У нашего больного были обнаружены практически все перечисленные изменения. Рентгенологически и, что важно, при эндоскопии мелкобугристая, местами ригидная, с язвенными дефектами, легко кровоточащая слизистая симулирует неопластическое заболевание (особенно, когда «бугорчатка» до этого момента не установлена). Если же подобная картина дополняется исхуданием больного, анорексией, субфебрилитетом и анемией, то даже при выявленном туберкулезе клинические стереотипы возобладают над логикой диагноза.
При раке желудка минимальная симптоматика или ее полное отсутствие в потенциально курабельном периоде болезни приводят к тому, что больные обращаются к врачу слишком поздно. Однако с несвоевременным установлением этого грозного диагноза «благополучно» сосуществует ситуация обратная, зачастую не менее драматичная — гипердиагностика рака желудка.
Мы рассмотрели два редких, можно сказать, казуистических случая дифференциальной диагностики рака желудка. Когда-то М.П. Кончаловский писал: «Диагноз напоминает киноленту, которая неодинаково и различно раскрывается благодаря тому обстоятельству, кто в данный момент ее развертывает… Диагноз индивидуален и по отношению к больному, и по отношению к врачу». Анализируя представленные истории болезни, мы еще раз убеждались, как важно внимательно и непредвзято «развертывать киноленту» каждого конкретного человеческого страдания.
Источник
