Операция льюиса при раке желудка и пищевода
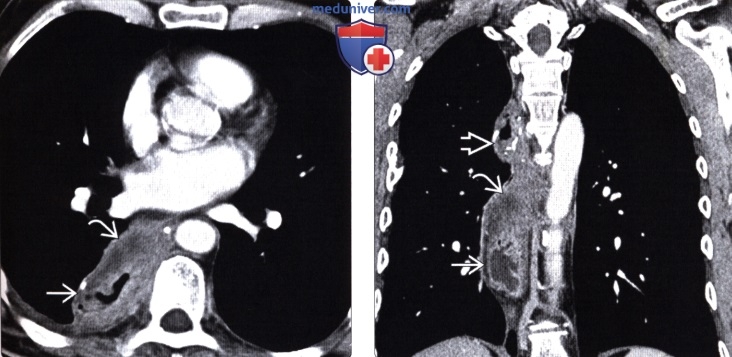
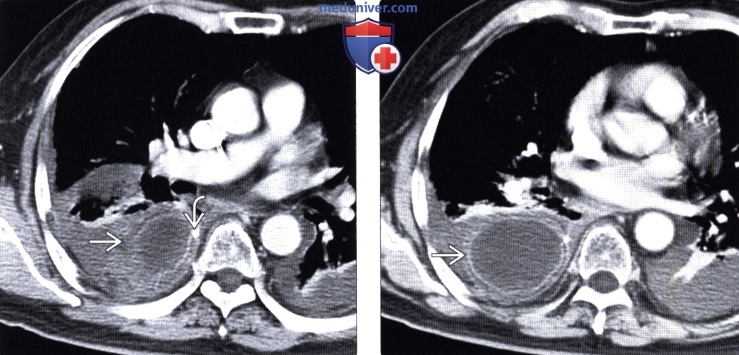
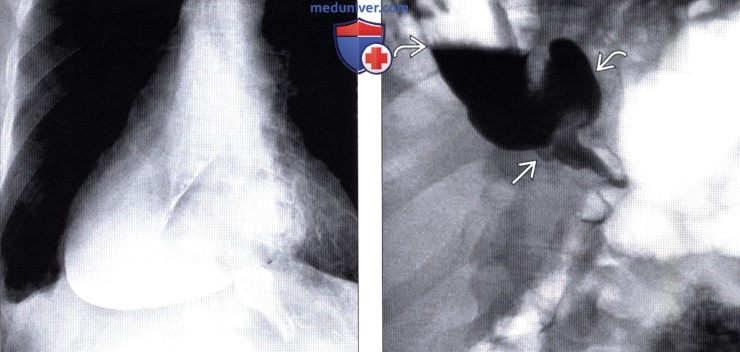
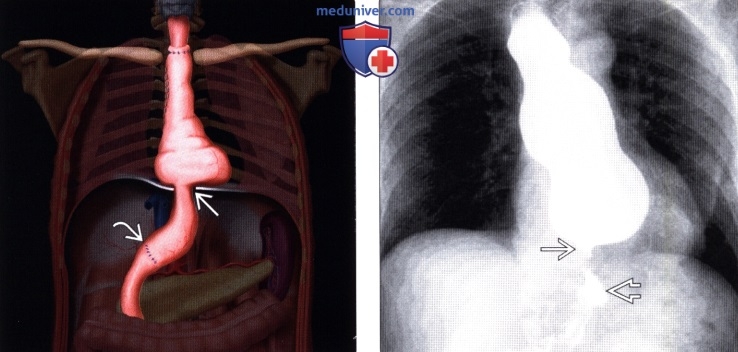
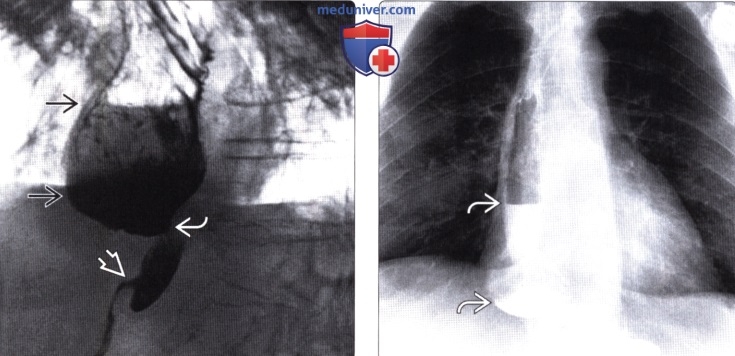
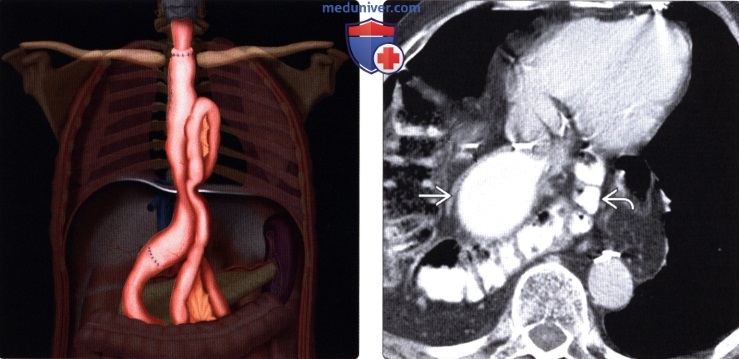
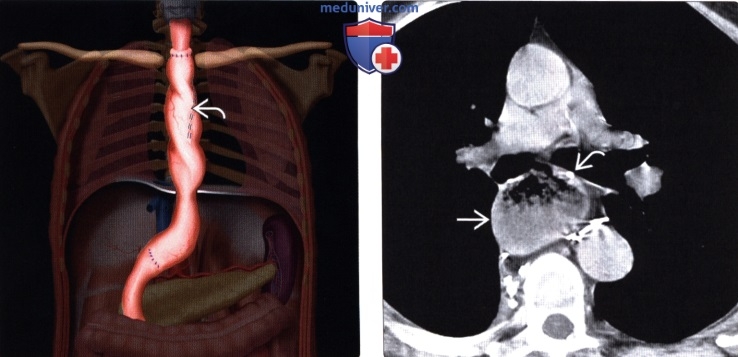
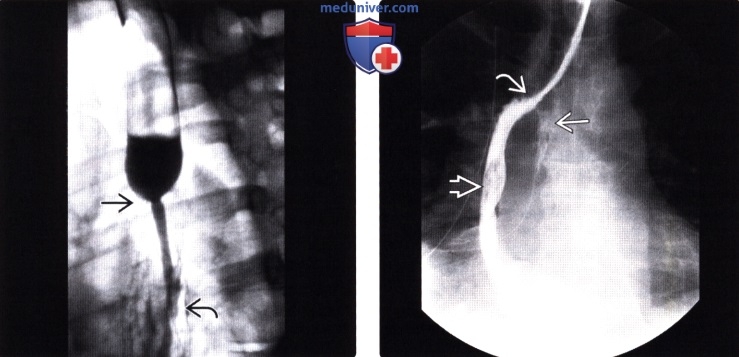
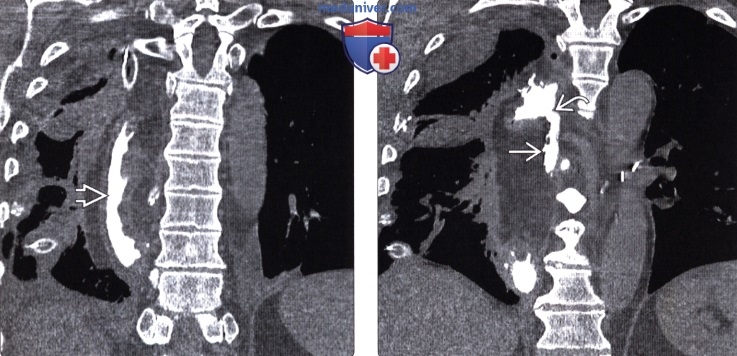
Рентгенография (эзофагография), КТ при эзофагэктомии Айвора Льюиса и других резекциях пищеводаа) Определение: б) Визуализация: 1. Оперативные вмешательства: • Данные об оперативном вмешательстве в анамнезе: • Существует множество вариантов резекции пищевода • Трансторакальная эзофагэктомия:
2. Осложнения эзофагэктомии Айвора Льюиса и других резекций пищевода: • Во время операции: • Послеоперационные:
3. Рекомендации по визуализации:
в) Клинические особенности. Развитие заболевания и прогноз: г) Список использованной литературы: – Также рекомендуем “Лучевая диагностика доброкачественной опухоли пищевода” Редактор: Искандер Милевски. Дата публикации: 31.1.2020 |
Источник
Злокачественное новообразование пищевода занимает шестое место по распространенности среди онкологических заболеваний. Развивается наиболее часто из эпителиальных клеток его слизистой оболочки (карцинома), реже наблюдается плоскоклеточный рак, редко – аденокарцинома, крайне редко – другие виды злокачественных новообразований.
Причины
Причины развития рака пищевода, как и других злокачественных опухолей, в настоящее время полностью не изучены. Большое значение имеет действие химических, механических или термических раздражающих факторов на слизистую пищевода, приводящее к возникновению хронического воспаления пищевода – эзофагиту, с последующим изменением его клеток (дисплазией). Клеточные изменения вследствие действия повреждающих факторов нарастают на фоне повышенной митотической активности (более интенсивного деления клеток) и приводят к злокачественному перерождению тканей пищевода и возникновению рака. Рак чаще возникает в верхней части пищевода, чем в нижней.
Поскольку рак возникает, как правило, на фоне хронического эзофагита, то заболевания, при которых наблюдается длительный воспалительный процесс в пищеводе, современная медицинская наука рассматривает как предрасполагающие к онкологическому заболеванию, или предраковые состояния. К таким состояниям относят пищевод Баррета (осложнение диафрагмальную грыжу).
Рак пищевода может быть обусловлен мутациями в гене р53, которые так же, как при поджелудочной железы, приводят к увеличению выработки аномального белка р53, не выполняющего свои функции защиты тканей от злокачественного перерождения. Причиной возникновения рака пищевода может быть вирус папилломы человека. Этот микроорганизм, в частности, был обнаружен в большом проценте случаев у больных раком пищевода жителей Китая (в ходе проводимых в этой стране исследований).
Способствуют развитию заболевания особенности питания, в частности, употребление горячей и грубой пищи, маринадов, алкоголя; дефицит витаминов, особенно В2 и А, а также железа, меди и цинка; вредные привычки (курение, алкоголь, жевание табака). Большой риск связан с сочетанием табака и алкоголя.
Симптомы
Начальные стадии рака пищевода протекают без симптомов. Проявляется заболевание только тогда, когда происходит нарушение процесса проглатывания и продвижения пищи по пищеводу. Это нарушение возникает при частичном перекрытии просвета пищевода растущей внутрь опухолью. Наличие небольшой опухоли может вызывать спазм стенки и, как следствие, поперхивание едой. При дальнейшем росте новообразования и перекрытии им большей части просвета пищевода больной может потерять способность к нормальному питанию, которое без специальных мероприятий приводит к истощению организма. Задержка пищи выше места сужения приводит к возникновению пищеводной рвоты, срыгиванию слюной и слизью.
Боль невысокой интенсивности за грудиной с иррадиацией в межлопаточную область при прохождении пищи и/или слюнотечение являются поздними симптомами и часто связаны с сопутствующим эзофагитом или прорастанием опухоли в соседние органы. При локализации рака в зоне кардии (перехода пищевода в желудок) первым признаком может быть не нарушение проглатывания и продвижения пищи, а постоянное срыгивание воздуха.
При росте опухоли за пределы пищевода она может сдавливать дыхательные пути с нарушением дыхания. Она также может сдавливать или прорастать в нервные стволы, располагающиеся рядом со стенкой пищевода, приводя к осиплости голоса, кашлю, развитию синдрома Горнера (опущение верхнего века, сужение зрачка, ослабление реакции зрачка на свет, расширение сосудов конъюнктивы глаза, западение глазного яблока, нарушение потоотделения на лице и покраснение кожи лица).
Болезни со сходными симптомами
При глотания (дисфагия), но эти нарушения имеют тенденцию к прогрессированию, хотя и очень медленному. Данное состояние также сопровождают ночной кашель, регургитация (движение в обратном направлении) или аспирация (вдыхание) пищевых масс, иногда повышенное выделение слизи при срыгивании, что связано с застоем в пищеводе. Периодическое возникновение нарушений глотания во время болевого приступа за грудиной свидетельствует в пользу спазма пищевода. Дисфагия сопровождает и раннюю стадию поражения пищевода при склеродермии, но при этом развивается рефлюкс (забрасывание) содержимого желудка в пищевод. Кроме того, дополнительными признаками склеродермии могут быть истончение кожи с просвечиванием подкожных сосудов, уменьшение амплитуды дыхательных движений.
Диагностические обследования
При развитии дисфагии (нарушений проглатывания и продвижения пищи) диагностическое значение имеет оценка ее выраженности и локализации. Наличие дисфагии дает основание заподозрить рак пищевода. Основными методами диагностики являются рентгенологический и эндоскопический с обязательным морфологическим исследованием образцов тканей из измененных участков слизистой оболочки пищевода.
Рентгенография пищевода
При рентгенографии пищевода, прежде всего, проводят исследование функции глотания с использованием рентегноконстрастных веществ (сульфата бария) различной консистенции, за исключением выраженного сужения просвета пищевода, когда необходимо использовать водорастворимый контрастный препарат.. Это позволяет выявить, где наблюдаются нарушения: в глотке или в пищеводе. Если причина дисфагии в нарушении функции пищевода, то следующим этапом обследования должна быть оценка того, какая пища ее вызывает: только твердая или твердая и жидкая. Нарушение глотания твердой пищи предполагает наличие механической непроходимости пищевода и может быть обусловлено ранними проявлениями целого ряда заболеваний. Пожилой возраст, отсутствие изжоги, снижение массы тела – это факторы, помогающие диагностировать опухоль.
Рентгенография позволяет получить информацию не только о локализации, протяженности поражения, но и о состоянии органа в целом. Так как в вертикальном положении контрастное вещество быстро эвакуируется из пищевода, рентгенологическое исследование выполняют в положении пациента стоя и лежа.
Эндоскопическое исследование
На ранних этапах заболевания, когда оно протекает бессимптомно, обнаружить его можно только при эндоскопическом обследовании. Эта диагностическая процедура является методом, позволяющим помимо визуального осмотра слизистой пищевода взять для исследования ее часть для морфологического и гистологического исследования. В последние годы широко используется эндоскопическая ультрасонография, которая дает возможность оценить распространение опухоли в стенке пищевода и состояние прилежащих тканей, а также регионарных лимфатических узлов. Применение этого метода диагностики значительно повысило частоту выявления ранних форм рака пищевода, в том числе локализующихся только в пределах слизистой оболочки (рак in situ).
Другие методы
Отдаленные метастазы рака пищевода определяются при ультразвуковом исследовании и рентгеновской компьютерной томографии. При подозрении на прорастание опухоли в соседние структуры, прежде всего в бронхиальное дерево, необходимо провести исследование верхних дыхательных путей, в том числе бронхоскопию с морфологичеким изучением промывных вод бронхов и биопсийного материала.
Лечение. Профилактика
Основными методами лечения рака пищевода являются хирургические и все более широко применяемые эндоскопические.
Хирургические методы лечения
В лечении рака пищевода основное значение придается хирургическим методам, а также комбинации лучевой терапии и оперативного вмешательства. Очередность сочетания, объем лучевой нагрузки и комбинация ее с оперативным вмешательством зависят от стадии заболевания и локализации опухоли.
Основные виды хирургических операций:
• Экстирпация пищевода – радикальная операция, предусматривающая удаление пораженного пищевода вместе с регионарными лимфатическими узлами и окружающей жировой клетчаткой. Выполнение такой операции возможно не более чем у 5% больных вследствие поздней диагностики рака, пожилого возраста пациентов и наличия у них тяжелых сопутствующих заболеваний. Она очень травматична, в последующем пациенты нуждаются в проведении реконструктивной пластики пищевода.
• Операция Гарлока (резекция нижней трети пищевода, части желудка с малым сальником и формирование пищеводно-желудочного анастомоза) выполняется при опухолях в нижней трети пищевода и в области его перехода в желудок (кардии). Результаты этого вида хирургического лечения лучше, чем при экстирпации пищевода.
• Операция Льюиса – одномоментная субтотальная резекция пищевода и пластика его желудком. Выполняется при раке среднегрудной части пищевода.
Эндоскопические методы лечения
• Эндоскопическая резекция слизистой пищевода. Во время этого вмешательства под опухоль в подслизистый слой вводится физиологический раствор для «приподнимания» зоны поражения, которая затем удаляется специальной полипэктомической петлей.
• Фотодинамическая нетермическая деструкция проводится с использованием лазера, спектр излучения которого находится в зоне наибольшей чувствительности используемого фотосенсибилизирующего препарата. Фотосенсибилизатор вводится за 2–3 суток перед манипуляцией, за это время он накапливается в клетках пораженной области слизистой и под влиянием излучения активируется, разрушая опухолевые клетки.
• Лазерная деструкция выполняется световодом, вводимым через эндоскоп. Из-за невозможности гистологического исследования тканей подобный вид лечения используется у пациентов, которым невозможно радикальное хирургическое лечение и для прогноза заболевания которых оценка глубины прорастания опухоли не имеет определяющего значения.
• Дилатация (расширение) суженной области пищевода выполняется специальными типами бужей (медицинские инструменты цилиндрической формы для введения в трубчатые внутренние органы) или баллонных катетеров (катетеры с надувающимися воздухом и увеличивающимися в объеме баллонами). Данные манипуляции используются при наличии опухолей, суживающих просвет пищевода. Подобное лечение имеет непродолжительный эффект и часто используется как первый этап перед применением других эндоскопических методов лечения.
• Реканализация просвета пищевода применяется при полностью или частично перекрытом просвете пищевода, чаще в верхней его трети. Для этих целей можно проводить курсовое лазерное лечение для деструкции (выжигания) опухоли. Повторные процедуры обычно проводятся через 1–2 недели (после отторжения некротичесих масс), курс состоит из 2–4 сеансов лазерного воздействия. Также опухоль можно разрушить термическим воздействием полипэктомической петлей или электрокоагуляцией, выполняемой моно- или биполярным электродом. Для разрушения опухоли применяется также 96° этиловый спирт, вводимый инъекционной иглой через канал эндоскопа 2–3 раза с интервалом 5–7 дней. Хорошие функциональные результаты при использовании различных методов реканализации (возможность питаться через рот плотной и кашицеобразной пищей) достигаются в среднем у 75% пациентов.
• Эндопротезирование выполняется для закрепления эффекта реканализации, восстановлении нормального способа питания через рот, а также для устранения сообщения пищевода и дыхательных путей при наличии пищеводно-трахеальных или пищеводно-бронхиальных свищей. В качестве протезов применяются трубчатые пластиковые протезы и металлические саморасправляющиеся стенты.
Лучевая терапия
Лучевая терапия при операбельном раке пищевода проводитсякурсами до и после операции. До операции лучевая терапия выполняется при недифференцированных и инфильтративной формах рака, а также при локализации опухоли в средней трети пищевода, то есть в анатомической области, где сложно выполнить радикальное удаление опухолевых тканей. После операции она проводится, если при хирургическом вмешательстве не удалось радикально убрать опухоль или если существует риск обсеменения окружающих тканей раковыми клетками. При неоперабельных опухолях лучеваятерапия используется в составе комплексных схем лечения с различными химиотерапевтическими препаратами. Например, применение комбинации цисплатины и 5-фторурацила в сочетании с лучевой терапией в дозе 50 Гр на область опухоли почти в 20% случаев приводит к полной регрессии опухоли.
Химиотерапия
Рак пищевода – опухоль, чувствительная к химиотерапии. Эффективность монотерапии при лечении такими препаратами, как фарморубицин, виндезин, блеомицин, митомицин, 5-фторурацил составляет от 15 до 20%. Использование схем комбинированной терапии с включением в их состав цисплатнины, позволяет достигнуть 40% эффективности при диссеминированном и до 70% при местнораспространенном опухолевом процессе.
Профилактика
Основным методом профилактики рака пищевода является выделение групп риска и обязательная диспансеризация пациентов, входящих в них. Для этого необходимо, чтобы врачи поликлиник проявляли онконастороженность при наблюдении пациентов с хроническим эзофагитом, пищеводом Баррета, стриктурами пищевода, ахалазией кардии и грыжей пищеводного отверстия диафрагмы, а сами пациенты не пренебрегали регулярными диагностическими обследованиями. Приранней диагностике рака пищевода возможности современной медицины позволяют эффективно лечить это заболевание.
Источник