Периневральная инвазия при раке желудка
Каждый пациент на приёме у врача больше всего боится, что у него заподозрят или, что хуже, найдут новообразование. Однако мало кто знает о механизме развития опухоли и за счет чего конкретно данный диагноз является настолько страшным. В этой статье мы разберёмся, что именно делает онкологические заболевания такими опасными для жизни.
Строение тканей с точки зрения формирования опухолевого процесса
Чтобы разобраться в механизме образования и развития опухоли, необходимо иметь представление о принципе строения тканей в организме. Большинство тканей, независимо от места их расположения, имеют сходный план строения:
- Базальная мембрана — это неклеточная структура, отграничивающая ткани друг от друга;
- Ростковый слой — группа активно делящихся клеток, расположенных на базальной мембране, которые обеспечивают обновление ткани. Именно изменение генетического материала клеток росткового слоя влечёт за собой развития опухоли;
- Слой созревающих клеток — клетки ростового слоя, которые постепенно продвигаются в верхние слои в процессе дифференцировки (приобретения формы и свойств, характерных для данной ткани);
- Поверхностный слой — группа клеток, которая и обеспечивает выполнение тканью определённой функции.
Между ростковым и поверхностным могут располагаться дополнительные слои в зависимости от конкретного вида ткани. Но принцип строения всегда один и тот же: клетки, способные делиться, находятся на базальной мембране. В процессе созревания они перемещаются в верхние слои, утрачивая способность к делению и приобретая специфические свойства.
Доброкачественные и злокачественные опухоли: в чем разница?
Исходя из того, клетки какого слоя подверглись мутации, выделяют два типа неоплазий — доброкачественные и злокачественные. Их отличия заключаются в том, что первый тип формируется из высоко дифференцированных клеток созревающего слоя. При доброкачественных опухолях клетки не будут сильно отличаться от здоровых клеток данной ткани. Такая неоплазия считается неагрессивной и растет медленно, а также не даёт метастазы. Патогенное действие доброкачественного новообразования заключается главным образом в сдавлении окружающих её тканей. Иногда такие опухоли полностью или частично закрывают просвет какого-либо полого органа.
Злокачественные новообразования возникают из-за мутаций клеток низкодифференцированного росткового слоя. Опухолевый рост происходит стремительно, из-за чего новообразование нуждается в активном питании. Эта потребность удовлетворяется за счет собственных ресурсов организма: новообразование обкрадывает своего носителя. Именно злокачественные неоплазии принято называть «раком». К доброкачественным образованиям этот термин не относится. При злокачественных опухолях происходит инвазия раковых клеток.
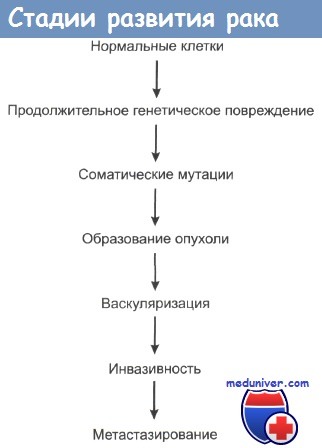
В процессе развития рака выделяют 4 стадии:
- Стадия предопухоли. В этот период наблюдается изменение клеток росткового слоя: они могут увеличиваться в размерах и приобретать нетипичные формы.
- Стадия неинвазивной опухоли. Ещё одно название этой стадии — «рак на месте» (или «рак in situ»). Клетки росткового слоя всё также созревают и продвигаются наверх, хотя теперь их структура и свойства изменены. Поэтому в стадии неинвазивной опухоли мы будем видеть изменения не только в самом глубоком слое.
- Стадия инвазивного роста — прорастание через базальную мембрану.
- Стадия метастазирования.

Что такое инвазия опухоли?
Данный термин происходит от латинского слова «invasio», что переводится как «нашествие» или «нападение». Инвазия — это процесс распространения раковых клеток посредством прорастания опухоли через базальную мембрану.
Инвазия обуславливает способность опухолей давать метастазы — вторичные очаги онкологического процесса вдали от материнской опухоли, возникшие из-за миграции раковых клеток. Обязательное условие метастазирования — наличие у опухоли собственной капиллярной сети. Она формируется, когда количество неопластических клеток достигает 103 (1-2 мм).
Этапы инвазии:
- Разрыв межклеточных связей, соединяющих раковые клетки между собой;
- Прикрепление клеток опухоли к базальной мембране;
- Разрушение базальной мембраны лизирующими (расщепляющими) ферментами;
- Миграция клеток в соседние ткани и органы.
Раковые клетки, находящиеся в процессе инвазии, более устойчивы к облучению и химеотерапии, чем стационарные. Во многом это связано с временной утратой мигрирующими клетками способности к делению. Также движущиеся опухолевые клетки проявляют повышенную активность антиапоптотических генов (гены, препятствующие запрограммированной смерти клетки — апоптозу). И, поскольку химиотерапевтические препараты направлены на стимуляцию апопоза, их устойчивость к лечению возрастает.
Инвазивный рост опухоли не только способствует её распространению по всему организму, но и обеспечивает раковым клеткам интенсивное питание. Поэтому можно сказать, что инвазия является фактором «укоренения» новообразования.
Факторы, определяющие степень инвазивности опухоли
Чтобы злокачественная опухоль проросла сквозь базальную мембрану, необходимо наличие следующих факторов:
- Быстрое деление и давление. Механическое воздействие опухолевой массы на базальную мембрану способствует её разрушению и, как следствие, инвазии раковых клеток;
- Подвижность клеток. Клетки новообразования способны к миграции, причем их движение не является хаотичным. Они движутся в направлении большей концентрации кислорода, питательных веществ, а также в сторону более нейтрального показателя кислотности (рН);
- Межклеточные связи. Чем прочнее эти контакты, тем меньше шансов, что опухоль начнет инвазивный рост. У злокачественных клеток связи слабые, поэтому клетки легко отрываются от новообразования и попадают в кровоток или в лимфатическую систему;
- Действие лизосомальных ферментов. Злокачественная опухоль вырабатывает вещества, способные разрушать здоровые клетки и межклеточное вещество, что будет способствовать инвазии;
- Иммунная система человека. В организме существует собственная противоопухолевая защита, которую обеспечивает наш иммунитет. Её активность у каждого человека индивидуальна. Она зависит от генетической предрасположенности и состояния всего организма в конкретный момент. Так, при заболеваниях, сопровождающихся угнетением иммунной системы (например, при ВИЧ), пациенты могут погибать от онкологических заболеваний, возникших из-за отсутствия противоопухолевой активности.
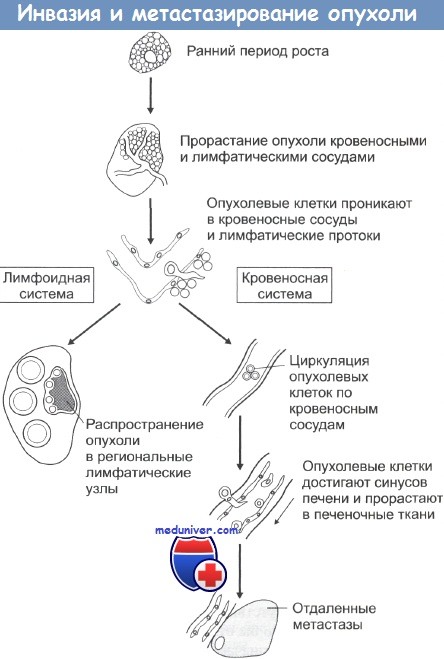
Инвазия раковых клеток в сосуды
Вслед за прорастанием в базальную мембрану наступает интравазальная (внутрисосудистая) инвазия опухоли. Чаще раковые клетки мигрируют в артерии. Это связано с тем, что стенки артерий более упругие и эластичные, в то время как у вен они тонкие и легко спадаются в опухолях. Однако раковые клетки могут быть занесены в вены из лимфатических сосудов.

Способствует интравазации также «неполноценность» сосудов, снабжающих злокачественное новообразование. Их базальная мембрана имеет щели, дефекты и истончения, что позволяет раковым клеткам с лёгкостью ее преодолеть. Такая структура обусловлена снижением продукции компонентов базальной мембраны или повышенной активностью разрушающих ее протеаз.
Циркуляция раковых клеток в системе кровотока и экстравазация
При попадании в кровоток опухолевая клетка покрывается фибрином и тромбоцитами, формируя микротромбоэмбол с опухолевой «сердцевиной». Не все они переживают движение в кровяном русле. Разрушение раковых клеток может быть обусловлено иммунными механизмами, а также турбулентностью кровяного потока и механическим повреждением во время циркуляции. Но около 80% деформированных клеток всё-таки сохраняют способность к размножению.
Экстарвазация представляет собой выход опухолевых клеток из сосудов для формирования метастатического очага. В этом процессе задействованы те же ферменты, что и в инвазии через базальную мембрану.
Резюме
Вот что следует знать об инвазии опухолей:
- Инвазия — это проникновение раковых клеток через базальную мембрану ткани, из которой развилась опухоль;
- Инвазия свойственна только злокачественным новообразованиям;
- В инвазии участвуют лизирующие ферменты, которые способны разрушать как неклеточные структуры, так и связи между здоровыми клетками (например, выстилка сосудов);
- Явление инвазии лежит в основе метастазирования;
- Инвазия бывает индивидуальной и групповой, и последняя чаще обуславливает появление метастазов,
- Самые распространенные виды инвазивных опухолей — рак шейки матки и рак молочной железы.
Источник
Инвазия, ангиогенез и метастазирование опухолевых клеток – ракаМожно сказать, что раковые клетки в определенной степени не реагируют на механизмы, контролирующие рост и развитие нормальной ткани. При пролиферации нормальной ткани непосредственный контакт клетки со своими соседями обычно служит сигналом к прекращению размножения. Это контактное торможение отсутствует в опухолевых тканях. При подкожном введении раковых клеток иммунодефицитным мышам происходит рост и развитие опухоли, что никогда не случается при введении здоровых клеток. Раковые клетки отличаются от здоровых по составу мембранных гликопротеинов, по микропотенциалам на клеточной мембране, а также характеризуются повышенным содержанием сиаловой кислоты. Локомоторный клеточный аппарат (микротрубочки и микрофиламенты) раковых клеток деградирует, клетка теряет присущие ей формы, отмечается миграция цитоплазмы раковой клетки в зону контакта со здоровыми клетками. Одновременно раковые клетки становятся локально инвазивными, хотя биохимические основы этого свойства до сих пор четко не выявлены. Опухолевые клетки часто демонстрируют пониженную адгезивность в сравнении с нормальными клетками. Важным моментом механизма инвазии является секреция определенных ферментов. Некоторые ферменты играют ключевую роль в протеолизе внутриклеточного матрикса, который всегда сопровождает инвазию раковых клеток. К таким ферментам относится семейство матричных металлопротеиназ (ММП), которое включает в себя колллагеназы, желатиназы и стромолизины. Эти ферменты экскретируются в неактивной форме. Последующий разрыв сульфгидрильной группы и присоединение атома металла (чаще всего цинка) приводят к изменению конформации фермента и переводят его в активное состояние. Тканевые ингибиторы металлопротеиназ (ТИМП) прекращают действие этих ферментов. Некоторые типы тканей изначально обладают повышенной устойчивостью к инвазии. Это, например, компактная костная ткань, ткани крупных сосудов и хрящевая ткань. Предположительно способность к инвазии у опухолевых клеток появляется в результате трансформации нормальных процессов реконструкции и восстановления здоровых тканей. Тем не менее к настоящему моменту неизвестно, какие конкретно изменения генетической структуры раковых клеток ответственны за инвазивный рост. По мере роста опухоли она выделяет в кровь ангиогенные факторы, которые стимулируют прорастание опухоли кровеносными сосудами и формирование сети капилляров. Сосудистая система кровоснабжения опухоли может стать мишенью для различных видов противораковой терапии. Опухоль стимулирует пролиферацию эндотелиальных клеток, выделяя ангиогенные цитокины, такие как эндотелиальный фактор роста сосудов (ЭФРС), ТФР и факторы роста фибробластов. Эндотелиальные же клетки в свою очередь могут стимулировать рост клеток опухоли. В одном грамме опухолевой ткани может находиться до 10-20 млн эндотелиальных клеток, которые не являются неопластическими.
Антигены нормальных эндотелиальных клеток, включая и профакторы свертываемости крови, могут быть разрегулированы в активно пролиферирующей под действием опухоли эндотелиальной ткани. В дополнение к действию цитокинов, гипоксия, развивающаяся в сети опухолевого кровоснабжения, может стимулировать выбросы ЭФРС и других факторов. В ходе ангиогенеза эндотелиальные клетки внедряются в строму опухоли, активно делятся там с образованием зачатков новых капилляров, которые затем развиваются в сосудистую систему опухоли. Как и в случае инвазии опухолевых клеток, этот процесс идет с участием продуцируемых эндотелием ММП и их естественных ингибиторов. При локальной инвазии рака опухолевые клетки могут попадать в сосудистую систему и давать начало метастазам. Последовательность событий при метастазировании показана на рисунке. Распространение раковых клеток по лимфатической системе, что особенно характерно при карциномах, происходит при попадании опухолевых клеток в лимфатические протоки с последующим оседанием их в местах разветвления протоков и в ближайших лимфатических узлах. Вслед за этим обычно происходит инфильтрация опухолевыми клетками и отдаленных лимфоузлов. Распространение через кровяное русло проходит при проникновении раковых клеток в кровеносные сосуды рядом с местом первичной локализации опухоли либо через грудные протоки. Подхваченные током крови раковые клетки затем захватываются ближайшими капиллярными сетями, чаще всего сетями печени и легких, и оседают в них. При оценке направлений метастазирования очень важно учитывать первичную локализацию опухоли. Например, опухоли пищеварительного тракта обычно метастазируют через воротную вену в печень. Опухоли также могут метастазировать непосредственно сквозь прилегающие ткани. Так возникающие в брюшной полости новообразования могут очень быстро рассеяться по всему внутрибрюшинному пространству, а клетки рака легкого могут мигрировать через плевру. Некоторые опухоли метастазируют в определенные органы и ткани, другие — бессистемно. Саркомы, например, почти всегда метастазируют в легкие, рак молочной железы поражает также ткани осевого скелета. Тем не менее биологических механизмов, объясняющих такую избирательность, пока не найдено. Региональные лимфоузлы могут осуществлять барьерную функцию, предотвращая распространение метастазов за пределы области первичной локализации опухоли. До сих пор четко не выяснено, каким образом и за счет каких специфических иммунных механизмов лимфатические узлы создают барьер на пути распространения опухоли.
Проникая в кровеносное русло в районе первичной опухоли, раковые клетки затем могут достигать других органов и тканей. Для того чтобы дать начало новым очагам опухоли, эти клетки на новом месте должны, во-первых, проникнуть в ткани через эндотелий капилляров, а во-вторых, выжить при атаках местных иммунных систем защиты, таких как фагоцитирующие клетки и так называемые естественные киллеры (ЕК). Способность к инвазированию и расселению в отдаленных органах и тканях у различных видов опухолей сильно варьирует. Эта способность, по-видимому, определяется степенью экспрессии того участка генома, который и обусловливает злокачественный рост клеток. Действительно, со временем почти все раковые опухоли накапливают все больше и больше генетических изменений в своих клетках и приобретают способности к инвазии и метастазированию. Но даже при клиническом обнаружении опухоли метастазы и инвазия могут проявиться лишь спустя несколько лет. Типичным примером является карцинома низкой степени злокачественности. Следует отметить, что даже однотипные виды рака с одинаковой степенью дифференцированности опухолевых клеток по-разному метастазируют у разных больных. Все это говорит о необходимости поиска молекулярных маркеров, которые смогли бы предсказывать исход течения онкологического заболевания более точно, чем диагностика по гистологическому типу опухоли (хотя последний метод в настоящее время является наиболее точным из всех возможных). Кроме того, даже конкретная опухоль может быть в значительной степени гетерогенной и состоять из клеток, различных по своему метастатическому потенциалу, что было показано на клонированных субпопуляциях, выделенных из одной опухоли. Биологические причины такой вариабельности в настоящее время неизвестны. Совершенно ясно, что для успешного лечения онкологических пациентов необходимо проводить масштабные исследования в области нахождения механизмов тканевой инвазии, метастатического роста и поиска биологических причин гетерогенности опухолей. Отсутствие гомогенности в опухолях, сходство опухолевых клеток со здоровыми клетками породившей ее ткани, и отсутствие четкого единичного критерия, по которому можно было бы отличить раковую клетку от здоровой, — все это вместе означает, что наши рассуждения о противоопухолевом иммунитете или о механизмах действия лекарственных цитостатических препаратов должны приниматься с изрядной долей скептицизма, особенно если они базируются на экспериментах с гомогенными опухолевыми культурами. – Также рекомендуем “Иммунный ответ на опухолевые клетки – рак” Оглавление темы “Механизмы роста и развития рака”:
|
Источник
Эффективность лечения рака толстой или прямой кишки зависит от того, насколько далеко он успел распространиться. Чем меньше поражение тканей, тем выше шансы на успех.
Если же заболевание дошло до других органов (рак стал метастатическим), правильная терапия поможет контролировать процесс и даст возможность продлить жизнь, сохранив её нормальное качество.
Что влияет на план лечения рака кишечника
- характеристики клеток опухоли (есть ли в них специфические мутации на которые можно повлиять особыми препаратами)
- стадия
- возраст и состояние здоровья человека
- сопутствующие заболевания
Какие методы лечения используют для рака кишечника
- операция
- лучевая терапия
- химиотерапия
- иммунотерапия
Двум людям с заболеванием одной стадии нередко нужно разное лечение, его выбирают в зависимости от сочетания факторов. Врач обязательно обсудит разные варианты с пациентом и его семьей, расскажет о возможных рисках и побочных эффектах разных методов.
Хирургическое лечение рака кишечника
В ходе операции хирург удаляет часть толстой кишки с опухолью/полипом и немного здоровой ткани по сторонам от злокачественного новообразования, плюс лимфатические узлы, расположенные рядом.
Важно делать операцию именно у онкологических хирургов с опытом работы с таким заболеванием, потому что объем операции отличается, например, количеством удаляемых лимфоузлов.
Чаще после операции два конца толстой кишки сшивают, поэтому такая операция не влияет на работу кишечника. Но так получается сделать не всегда. Иногда один конец выводят и фиксируют специальным образом на коже боковой поверхности живота. Это так называемая колостома. В дальнейшем каловые массы поступают из толстой кишки через колостому в калоприёмник. Его также иногда устанавливают на время, до того, как проведут операцию по воссоединению толстой кишки, если её невозможно провести сразу.
После хирургического вмешательства возможен более жидкий стул. Это происходит из-за того, что в ходе операции кишка укорачивается, соответственно, уменьшается и поверхность, всасывающая воду в процессе нормального пищеварения.
Основные способы хирургического лечения рака толстой кишки
- Открытая операция. Толстую кишку оперируют через разрез на животе.
- Лапараскопическая операция. На животе делают несколько небольших разрезов, в один из которых помещается лапароскоп, который помогает хирургам увидеть брюшную полость на экране. Через другие разрезы вводят хирургические инструменты. Такой тип операции не менее эффективен, зато не так травматичен, восстановление после неё обычно происходит легче.
Химиотерапия
При химиотерапии человеку вводят препараты, которые уничтожают раковые клетки или замедляют их рост. Химиотерапия, которую предполагается делать после операции, называется профилактической или вспомогательной (адъювантной). Её применяют дополнительно к хирургическому лечению, чтобы разрушить клетки, находящиеся за пределами опухоли. По данным исследований, она увеличивает вероятность излечения и предотвращает рецидив.
Некоторые виды химиотерапии имеют побочные эффекты, и ваш врач подскажет, как облегчить состояние.
Химиотерапию не рекомендуют при раке толстой кишки на начальной и I стадиях. При раке II стадии важно подробно обсудить с доктором все риски и пользу химиотерапии, поскольку клинические исследования показали, что польза от такого лечения не всегда есть, а если всё же есть, то скромная. Однако некоторым пациентам со II стадией заболевания химиотерапия подходит.
При II стадии рака кишечника решение в сторону химиотерапии врачи принимают, если есть высокий риск рецидива. Химиотерапию делают, если:
- опухоль низкодифференцирована, то есть состоит из незрелых и поэтому более агрессивных клеток, которые могут быстро расти и распространяться,
- во время операции удалили менее 12 лимфоузлов,
- есть перфорация (отверстие в кишке) и/или кишечная непроходимость,
- есть периневральная и лимфоваскулярная инвазия (это такая характеристика опухоли, её определяют при изучении образца ткани),
- края резекции положительные или неизвестные (это тоже известно по результатам исследований.
Если факторов риска при II стадии нет, то нужно определить микросателлитную нестабильность. Это показатель того, что система починки ДНК в клетках не работает, как должна, и в результате в таких клетках накапливаются мутации.
Если мы находим такое явление в опухолевых клетках, то химиотерапию не проводят, потому что понятно, что она не принесёт пользу, а вот токсичное действие на организм может оказывать.
Лучевая или радиотерапия
Лучевую терапию используют в некоторых ситуациях:
- паллиативная лучевая терапия нужна, чтобы уменьшить симптомы: например, когда метастаз в печени перекрывает желчные протоки и развивается желтуха или когда есть боль из-за метастаза в позвонке;
- радиотерапия одиночных метастазов – когда мы можем полностью избавится от метастазов и радиотерапия для этого предпочтительный по клинической ситуации метод. Например, когда метастаз нельзя удалить хирургически по техническим причинам. Решение в каждом конкретном случае зависит от ситуации.
Иммунотерапия
Иммунотерапия – это лечение современными препаратами. Лечение не имеет ничего общего с «поднятием иммунитета» иммуномодуляторами, травами или другими народными средствами.
При особом состоянии системы восстановления ДНК опухолевой клетки – микросателлитной нестабильности (в результатах специальных исследований ее обозначают MSI-H, либо dMMR) – иммунотерапию можно использовать для лечения метастатического рака кишечника. Подходящий для этого лечения тип опухоли, с высокой микросателлитной нестабильностью, встречается в 17% случаев. Для анализа нужен образец опухоли (парафиновый блок) и иногда образец крови.
Прогноз при раке кишечника
Говоря о прогнозе при разных стадиях заболевания врачи ориентируются на статистику, которую получают по итогам исследований эффективности разных способов лечения на больших группах пациентов. Однако статистика предоставляет лишь усредненные данные. Индивидуальный прогноз зависит от множества факторов, среди которых:
- возраст и общее состояние здоровья,
- стадия рака и показатель «агрессивности» опухоли, grade
- ответ опухоли на лечение
С помощью определенных калькуляторов можно рассчитать предоположительную выживаемость после радикальной операции, исходя из характеристик опухоли
Источник