Поражение сальника при раке желудка
«Рак брюшной полости» — строго говоря, такого термина в онкологии нет, и он не обозначает какую-то конкретную злокачественную опухоль. Чаще всего, когда произносят это словосочетание, имеют в виду первичные злокачественные новообразования или метастазы в брюшине, рак органов, которые находятся в брюшной полости.
Брюшная полость и брюшина — что это такое?
Брюшная полость — это пространство в животе, заполненное кишечником и другими внутренними органами. Сверху она ограничена диафрагмой, снизу — тазом, по бокам и спереди — мышцами брюшного пресса, сзади — позвоночником и поясничными мышцами.
Изнутри полость живота выстилает тонкая пленка из соединительной ткани — брюшина. Ее висцеральный листок, покрывает внутренние органы, париетальный — стенки брюшной полости. Между листками брюшины находится замкнутое щелевидное пространство, а в нем — минимальное количество жидкости, выполняющей функцию смазки и обеспечивающей свободное скольжение органов. В некоторых местах брюшина образует складки: брыжейки, на которых подвешены органы, сальники.
Внутренние органы могут быть расположены по отношению к брюшине по-разному:
- Интраперитонеально — покрыты брюшиной со всех сторон.
- Мезоперитонеально — покрыты частично.
- Ретроперитонеально (забрюшинно) — покрыты только с одной стороны.
Виды рака брюшной полости
Первичные опухоли брюшной полости встречаются редко. Они бывают разных типов: мезотелиальные, эпителиальные, гладкомышечные неопределенные. Особая разновидность злокачественных опухолей брюшины — псевдомиксома. Она развивается из клеток, которые продуцируют большое количество желеобразной жидкости. Чаще всего такие опухоли распространяются на брюшину из аппендикса.
Зачастую первичные злокачественные опухоли брюшной полости имеют строение и ведут себя, как рак яичников. Они вызывают сходные симптомы, и врачи применяют для борьбы с ними примерно одни и те же методы лечения.
Факторы риска
Известно, что в целом вероятность развития первичного рака брюшной полости выше у женщин, чем у мужчин. Риски повышаются с возрастом. Есть связь между вероятностью развития заболевания и изменениями в генах BRCA1, BRCA2.
При разных типах рака на поздних стадиях опухолевые клетки отделяются от первичного новообразования, распространяются по организму и образуют новые очаги в различных органах, в том числе в брюшной полости. Этот процесс называется метастазированием. Чаще всего в брюшину метастазирует рак толстой и прямой кишки (в 15% случаев), желудка (в 50% случаев), яичника (в 60% случаев), поджелудочной железы. Иногда метастазы распространяются из органов, которые находятся за пределами брюшной полости: молочной железы, плевры (пленки из соединительной ткани, покрывающей легкие и выстилающей стенки грудной полости), легкого.
Симптомы
Зачастую в течение длительного времени симптомы при раке брюшной полости отсутствуют, поэтому нередко его диагностируют на поздних стадиях. Проявления патологии неспецифичны, их можно легко принять за признаки других заболеваний:
- Дискомфорт, спазмы, вздутие живота.
- Повышенное газообразование в кишечнике.
- Жидкий стул.
- Запоры.
- Тошнота.
- Снижение аппетита.
- Частые мочеиспускания.
- Одышка.
- Быстрый набор или потеря массы.
- Кровотечения из прямой кишки, у женщин — из влагалища.
Если канцероматоз брюшины возник в результате метастазирования злокачественной опухоли из другого органа, сильно ухудшается прогноз. Противоопухолевая терапия начинает работать хуже, потому что многие препараты плохо проникают через брюшину.
Осложнения
Главное осложнение данного заболевания — асцит. Этим термином называют состояние, при котором в животе скапливается жидкость. В норме между листками брюшины ежедневно вырабатывается и всасывается около 1,5 жидкости. При канцероматозе нарушается отток лимфы, и жидкость всасывается хуже. Она начинает скапливаться внутри живота.
Пока жидкости немного, больной не испытывает каких-либо симптомов. Затем начинают беспокоить тяжесть, тупые боли в нижней части живота. Затрудняется дыхание, возникает одышка. Из-за того что жидкость сдавливает органы, больной жалуется на отрыжку, тошноту, проблемы со стулом и мочеиспусканием. Живот увеличивается в размерах, может возникать пупочная грыжа. При выраженном асците развивается сердечная недостаточность, отеки.
Диагностика рака брюшной полости
Злокачественную опухоль помогают выявить следующие методы диагностики:
- Ультразвуковое исследование. Зачастую его назначают в первую очередь, как простой, доступный, безопасный и в то же время информативный метод диагностики.
- Компьютерная и магнитно-резонансная томография помогают оценить состояние брюшины и внутренних органов, выявить патологические образования, оценить степень распространения рака.
- ПЭТ-сканирование в настоящее время является золотым стандартом для поиска отдаленных метастазов.
- Биопсия — самый точный метод диагностики злокачественных опухолей. Врач может получить образец опухолевой ткани во время диагностической лапароскопии — процедуры, во время которой через проколы в брюшной стенке в живот вводят миниатюрную видеокамеру и специальные инструменты. Образец отправляют в лабораторию, проводят его гистологическое, цитологическое исследование, молекулярно-генетический анализ. Это помогает не только диагностировать рак, но и установить природу опухолевых клеток, разобраться, какими препаратами с ними лучше бороться.
- Рентгеноконтрастные исследования помогают оценить состояние пищеварительного тракта, выявить опухолевые очаги и другие патологии.
- Анализ на онкомаркер CA-125 (углеводный антиген 125). Уровень этого вещества повышается в крови при раке брюшины и яичников. Но для диагностики этих заболеваний данный анализ недостаточно точен. Как правило, его применяют для контроля течения рака и эффективности лечения.
- Женщины должны пройти осмотр у гинеколога.
Обычно врачи-онкологи устанавливают диагноз на основании таких признаков, как асцит, утолщение брюшины, появление на ней узелков, смещение, сдавление петель кишки, патологические изменения со стороны печени и складок брюшины — сальников.
Лечение
Выбор тактики лечения зависит от локализации, размеров, стадии злокачественной опухоли, количества узлов. Врач также должен учитывать общее состояние больного, его возраст, наличие сопутствующих заболеваний.
Зачастую при поражении брюшины опухолевых очагов очень много, многие из них мелкие, и полностью их удалить невозможно. Хирургическое лечение направлено на удаление как можно большего числа очагов, как правило, оно предшествует химиотерапии. Обычно удаляют матку, яичники, участки кишечника, — словом, всё, что поражено злокачественной опухолью. Если злокачественное новообразование вызывает кишечную непроходимость или другие осложнения, проводят паллиативные хирургические вмешательства.
Для того чтобы уничтожить опухолевые клетки при первичном раке в полости живота, применяют химиопрепараты, зачастую те же, что при раке яичников. Лекарства вводят внутривенно или в брюшную полость — такая химиотерапия называется интраперитонеальной (внутрибрюшинной).
С 2018 года врачи Европейской клиники практикуют инновационный метод лечения канцероматоза брюшины — гипертермическую интраперитонеальную химиотерапию (HIPEC). Суть ее заключается в том, что хирург удаляет все достаточно крупные опухолевые очаги, а затем промывает полость живота подогретым раствором химиопрепарата. Это помогает уничтожить максимальное количество опухолевых клеток и существенно продлить жизнь больного.
При асците наши доктора проводят лапароцентез (прокол в брюшной стенке и выведение жидкости), устанавливают перитонеальные катетеры для постоянного оттока, проводят хирургические вмешательства, которые препятствуют дальнейшему накоплению асцитической жидкости.
На поздних стадиях проводится паллиативное лечение, которое помогает уменьшить симптомы и продлить жизнь больного.

Прогноз и профилактика
Прогноз при первичном раке брюшины напрямую зависит от того, удалось ли удалить все опухолевые очаги во время хирургического вмешательства. К сожалению, зачастую заболевание диагностируют на поздней стадии, поэтому после лечения часто развиваются рецидивы. Обычно пациентам требуется более одного хирургического вмешательства, курса химиотерапии.
Канцероматоз брюшины при метастазах других типов рака резко ухудшает прогноз. Обычно продолжительность жизни таких больных измеряется месяцами. Но HIPEC может ее существенно продлить, до нескольких лет — в случае, если проведение такого лечения возможно у конкретного пациента.
Специальных мер профилактики данного заболевания не существует. Нужно в целом вести здоровый образ жизни, женщинам — регулярно проходить осмотры у гинеколога. Мера профилактики метастазов в брюшину — своевременная диагностика и лечение злокачественных опухолей.
Врачи в Европейской клинике берутся за лечение рака на любой стадии. Для нас не бывает безнадежных больных. Свяжитесь с нами, мы знаем, как помочь.
Источник
Канцероматоз брюшины — опухолевое поражение листков слизистой оболочки, покрывающей органы и внутреннюю стенку живота. Преимущественно обусловлен разрастанием метастазов рака в брюшной полости, иногда возможно развитие первичного злокачественного процесса — мезотелиомы в самой брюшине.
Метастатическое поражение правильнее называть «карциноматоз», поскольку карцинома — синоним рака. Аналогично метастазы саркомы в брюшину именуют «саркоматоз».
Частое, но не обязательное проявление перитонеального канцероматоза, — выработка асцитической жидкости. С асцитом или без, но поражение брюшины злокачественным процессом всегда угрожает жизни больного и требует очень непростого лечения.
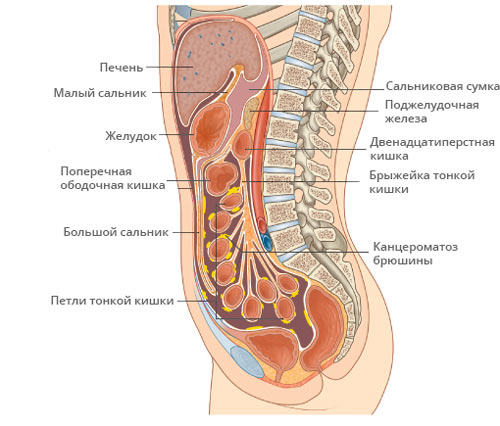
Причины канцероматоза брюшины
Не всякая оторвавшаяся от материнской раковой опухоли клетка способна стать метастазом, в кровеносном русле погибает львиная доля циркулирующих злокачественных клеток. Для обретения способности стать метастазом раковая клетка должна измениться внутренне — научиться вырабатывать вещества, позволяющие самостоятельно жить и внедриться в другом месте, подавляя нормальные клетки.
Оторвавшиеся от узла клетки мигрируют на большие расстояния, раздвигая нормальные клетки, имплантируются в брюшную слизистую, способны даже внедряться внутрь других клеток. После закрепления на местности, начинается размножение и образование целой клеточной колонии.
Кроме переноса метастатических клеток по крови и лимфе, распространение идёт и внутри полости живота — трансцеломически. Не совсем ясно почему злокачественные клетки задерживаются в брюшине, предполагается благотворное действие микроклимата. Большинство метастазов находят в местах с более спокойной обстановкой и слабой перистальтикой органов, или там, где активно всасывается внутрибрюшная жидкость.
Часто клетки «разбрасываются» во время операции и при лапароскопическом вмешательстве вероятность обсеменения вдвое ниже, чем при классической хирургии. Во время операции обязательно проводится профилактика раковой диссеминации путём неоднократной обработки специальными растворами, но самый эффективный способ очищения от диссеминатов — внутриполостная химиотерапия на фоне гипертермии (HIPEC).
При каких заболеваниях развивается
Перитонеальный канцероматоз диагностируют у каждого третьего пациента с новообразованием желудочно-кишечного тракта. Метастазы по брюшине характерны для карцином желудка и поджелудочной железы — поражается до 40% пациентов. При раке кишечника канцероматоз обнаруживают только у десятой части больных. Максимально высокий процент обусловлен злокачественными процессами яичников — на момент выявления болезни две из трёх пациенток уже имеют опухолевые узлы на брюшине.
Вероятность канцероматоза зависит от степени агрессивности раковых клеток и величины первичной опухоли, так при тотальном инфильтративном раке желудка его выявляют чаще, чем при локальном процессе, не разрушившем наружную серозную оболочку органа.
Тем не менее, ни при одном из злокачественных процессов любой локализации, будь то рак молочной железы или простаты, лёгкого или носоглотки, не исключается внутрибрюшинное метастазирование. Посмертно канцероматозные изменения выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Для сарком такая локализация метастазов нетипична, саркоматоз брюшины констатируется едва ли у трёх из сотни больных. В редчайших случаях совершенно доброкачественные по гистологии муцинозные аденома аппендикса и цистаденома яичников тоже способны привести к обсеменению брюшины с выработкой гелеобразного секрета.
У одного из миллиона, и много чаще это будет женщина, выявляют муцинозную аденому аппендикса или муцинозную цистаденому яичников, в последующем часто приводящие к обсеменению брюшины. Распространение аденомуцинозных клеток в полости живота с выработкой гелеобразного секрета именуют уже «псевдомиксома», зачастую при в этой стадии заболевания не удаётся определить первоисточник опухоли.
Диагностика канцероматоза брюшины
Не представляет трудности выявление опухолевого поражения брюшины при асците, в отсутствии выработки патологического секрета диагностика опирается на визуализацию — УЗИ и КТ с контрастированием.
При УЗИ на внутреннем листке, прилежащем к мышцам брюшной стенки, в норме очень тонком и незаметном, можно увидеть напластования толщиной в несколько сантиметров, практически не прослеживаются только мелкие узелки.
КТ с контрастным усилением много информативнее УЗИ, способно выявить сантиметровые образования. Наиболее точный диагностический метод — лапароскопия. Это обследование обязательно при карциноме желудка, при раке яичников предпочтительна операция — диагностика и лечение одновременно.
При лапароскопии или пункции получают асцитическую жидкость для исследования и определения первоисточника злокачественного процесса. Из экссудата выделяют осадок, который изучают под микроскопом и проводят специфические реакции — ПЦР и ИГХ.
ПЭТ на этапе первичной диагностики не всегда информативна, поскольку далеко не все злокачественные клетки легкого, печени, почек способны накапливать изотопы.
Вне всяких сомнений, самый оптимальный метод диагностики — получение кусочка опухолевой ткани для исследования. Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.
Стадии канцероматоза брюшной полости
Стадирование перитонеального канцероматоза нельзя назвать точным, все классификации приблизительны в определении объёма повреждений и не уточняют локализацию узлов. Зачастую, стадирование даёт общее представление о прогнозе эффективности лечебных мероприятий, нежели информирует о настоящем состоянии внутри полости живота.
Разработанная японскими специалистами градация опухолевого распространения по трём степеням, учитывает общий объём поражения, без числа и размеров очагов:
- P1 — ограниченное;
- P2 — разделённые нормальной тканью очаги;
- P3 — множество узлов.
Во время операции хирурги определяют индекс перитонеального канцероматоза (РСI), измеряя узелки в 13 регионах полости, общая сумма баллов влияет на тактику лечения, в первую очередь, на возможность удаления брюшины — перитонэктомию и целесообразность внутриполостной химиотерапии. При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
Наибольшее представление о размерах ракового повреждения даёт стадирование по степеням:
- 0 — в полости чисто,
- I — в одной анатомической зоне узелки до 5 мм,
- II — множественные узелки до 5 мм,
- III — локальное поражение 0.5–2 см,
- IV — 2-х сантиметровые узелки.
Течение канцероматоза определяется не столько размером метастатического узла, сколь клеточной потенцией к прогрессии и выработке асцитической жидкости, общей площадью опухолевой трансформации и клиническими проявлениями.
Симптомы канцероматоза брюшной полости
Перитонеальный канцероматоз небольшой протяжённости может не проявлять себя симптомами, особенно в отсутствии выработки асцитической жидкости. С другой стороны, жидкость может продуцироваться и при отсутствии видимых метастазов. Как правило, симптоматика неспецифична, и в разном наборе могут отмечаться:
- меняющие локализацию болезненные ощущения, а чаще — непонятный дискомфорт в полости живота;
- нарастающая слабость до утраты работоспособности;
- потеря веса при стабильном диетическом режиме;
- прогрессирующее снижение аппетита;
- функциональные нарушения со стороны органов ЖКТ.
Дальнейшее нарастание раковых повреждений сопровождается опухолевой интоксикацией, сдавление желудка опухолевыми узлами осложняется тошнотой и рвотой, кишечника — запорами и поносами с усугублением частичной непроходимости. Распад крупных узлов может вызывать боли и повышение температуры.
Асцит нарушает процесс дыхания и вызывает сердечную недостаточность с постоянными отёками, а частая эвакуация патологической жидкости приводит к белковой недостаточности.
Как лечат канцероматоз брюшины
Ни один из современных методов лечения канцероматоза не гарантирует радикального удаления опухоли, не способен излечить, но может улучшить состояние и существенно продлить жизнь.
Хирургическое лечение канцероматоза технически сложное для оперирующей бригады и трудно переносимое пациентом, поскольку предполагает удаление первичного рака, увеличенных лимфатических узлов, сальниковых сумок и всех видимых опухолевых образований вместе с брюшиной.

Перитонэктомия — многоэтапное вмешательство, включающее удаление нескольких органов и отделов брюшной полости. В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
Стандарт терапии канцероматоза — химиотерапия системная и локальная — внутрибрюшинная после удаления асцита или через лапаропорт, установленный во время операции.
Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Какие методики терапии дают лучший результат
Наиболее высокий эффект демонстрирует комбинация трёх методов лечения рака:
- Операция с максимально возможным удалением злокачественных новообразований — циторедукция.
- Локальная внутрибрюшинная гипертермия.
- Внутриполостное введение химиопрепаратов.
Использование во время хирургического вмешательства интраперитонеальной гипертермической химиотерапии (ИГХТ или HIPEC) позволяет максимально долго поддерживать очень высокую концентрацию цитостатика непосредственно в зоне поражения и усилить лекарственное воздействие нагреванием тканей. При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
Технология ИГХТ такова: в течение полутора часов внутрь брюшной полости под давлением подаётся нагретый химиопрепарат в дозе, существенно превышающей максимально разрешённую для внутривенного введения. За счёт локального использования изменяется спектр токсических реакций, исключается опасное для жизни повреждение кроветворения, но возможна боль в животе и временное нарушение функционирования органов ЖКТ.
Интраоперационная фотодинамическая терапия (ФДТ), когда на выявленные с помощью фотосенсибилизатора очаги опухоли воздействуют лазером, уступает HIPEC по результативности, поскольку лазером невозможно проникнуть во все «закоулки» брюшной полости. Тем не менее, целесообразно использование фотодинамической терапии при крупных и немногочисленных раковых узлах.
Прогноз при канцероматозном поражении
На течение процесса влияет объём поражения на момент начала терапии, степень злокачественности опухоли, в свою очередь определяющая чувствительность к химиотерапии. Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Однозначно революционные результаты в клинических испытаниях показала только HIPEC. После интраоперационной гипертермической ХТ пятилетняя выживаемость при канцероматозе рака желудка выросла максимально до 20%, все прочие методы исключали столь долгое дожитие. При раке толстой кишки с метастазами по брюшине каждый третий пациент прожил более 5 лет, при карциноме слепой кишки и аппендикса — шестеро из десяти вступили во вторую пятилетку жизни.
Список литературы
- Давыдов М.И., Тер-Ованесов М.Д., Буйденок Ю.В. с соавторами/ Гипертермическая интраоперационная интраперитонеальная химиотерапия при раке желудка: существует ли реальная возможность изменить прогноз? // Вестник РОНЦ им. Н. Н. Блохина РАМН; 2010 Т. 21; № 1
- Степанов И.В., Падеров Ю.М., Афанасьев С.Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5
- Akiyama H., Yamaoka H., Tanaka K., et al./ Continuous hyperthermic peritoneal perfusion for peritoneal dissemination of gastric cancer // Hepatogastroenterology; 1998.
- Bozzetti F., Bonfanti G., Morabito A., et al/ A multifactorial approach for the prognosis of patients with carcinoma of the stomach after curative resection // Surg. Gynecol. Obstet.; 1986.
- Cotte E., Passot G., Gilly F.N., Glehen O. /Selection of patients and staging of peritoneal surface malignancies // World J. Gastrointest. Oncol.; 2010; Vol. 2.
- Chua T.C., Moran B.J., Sugarbaker P.H., et al. /Early- and longterm outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy// J. Clin Oncol 2012.
- Deraco M., Santoro N., Carraro O., Inglese M.G., et al./ Peritoneal carcinomatosis: feature of dissemination. A review // Tumori; 1999.
- Lansom J., Alzahrani N., Liauw W., Morris D.L. /Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy for Pseudomyxoma Peritonei and Appendix Tumours // Indian J Surg Oncol. 2016 Jun.
- Sugarbaker P.H./ Overview of peritoneal carcinomatosis // Cancerologia; 2008.
Источник
