Венофер при раке желудка
Комментарии
Опубликовано в:
«ОНКОЛОГИЯ. ЖУРНАЛ им. П.А. ГЕРЦЕНА» »» № 2, 2012
С.В. МОИСЕЕВ
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН
Снеговой Антон Владимирович – канд. мед. наук, ст. науч. сотр., специалист по поддерживающей терапии отд. изучения новых противоопухолевых лекарств
Рассмотрена проблема анемии у онкологических больных. Одной из причин развития анемии является дефицит железа. Абсолютная или функциональная нехватка железа снижает эффективность применения рекомбинантного эритропоэтина, используемого для лечения анемии индуцированной химиотерапией. Многочисленные исследования показали, что внутривенные формы железа по сравнению с пероральными более эффективно восполняют дефицит железа необходимый для оптимального эритропоэза. Современные американские и европейские рекомендации (ESMO, NCCN) по лечению анемии у онкологических больных включают обязательное использование внутривенных форм железа.
Ключевые слова: анемия, химиотерапия, железодефицитная анемия, эритропоэз.
Iron preparations in the treatment of anemia in cancer patients
S.V. MOISEYEV
N.N. Blokhin Russian Cancer Research Center, Russian Academy of Medical Sciences
The paper considers the problem of anemia in cancer patients. Iron deficiency is one of the causes of anemia. Absolute or functional iron deficiency lowers the efficacy of recombinant erythropoietin used to treat anemia with induced chemotherapy. Numerous trials have shown that intravenous versus oral iron preparations are more effective in compensating for the lack of iron indispensable for optimal erythropoiesis. Today’s American and European guidelines (ESMO, NCCN) for the treatment of anemia in cancer patients include the compulsory use of intravenous iron formulations.
Key words: anemia, chemotherapy, iron-deficiency anemia, erythropoiesis.
В последние годы анемия привлекает к себе пристальное внимание ученых, так как является частым осложнением опухолевых заболеваний и противоопухолевой цитотоксической терапии. На фоне лекарственного лечения частота анемии среднетяжелой (НЬ 8-10 г/л) и тяжелой (НЬ 6,5-8 г/л) степени достигает 75%, что отрицательно сказывается на качестве жизни пациентов [1]. Кроме того, анемия ведет к тканевой гипоксии, снижает чувствительность опухоли к химиотерапии и лучевой терапии и является независимым прогностическим фактором, определяющим выживаемость онкологических больных [2].
В течение многих лет единственным методом лечения тяжелого анемического синдрома в онкологии была гемотрансфузия (ГТ), а точнее переливание донорской эритроцитарной массы. ГТ и сейчас используется при необходимости быстрого повышения уровня гемоглобина, хотя обладает множеством побочных эффектов и, по данным американских авторов, существенно увеличивает риск тромбоэмболии и смерти [3].
Создание и внедрение в практику лечения онкологических больных рекомбинантных человеческих эритропоэтинов (ЭПО) значительно снизило количество ГТ и обусловленных ими осложнений. При этом отмечено положительное влияние ЭПО на качество жизни пациентов [4]. Однако, являясь единственным патогенетическим методом лечения анемии, ЭПО не всегда позволяют достичь желаемого результата. Одной из причин этого может быть дефицит железа.
Спорные вопросы, касающиеся использования ЭПО у онкологических больных, достаточно подробно освещены в ряде отечественных публикаций [5, 6]. Целью данного обзора является оценка роли дефицита железа и препаратов для его коррекции в лечении анемии у онкологических больных.
Железо является функциональным компонентом большого числа ферментов, играющих важную роль в основных метаболических процессах. По мнению M. Aapro и соавт. [7], дефицит железа у онкологических больных составляет 30-60%.
Этиопатогенетические механизмы развития анемии при злокачественных опухолях многофакторны и сложны. Активация иммунной системы и гиперэкспрессия провоспалительных цитокинов (интерлейкины-1 и 6, фактор некроза опухоли, интерферон-гамма и др.) нарушает продукцию эндогенного эритропоэтина, эритроцитов и метаболизма железа [8-10].
Гепсидин – гормон синтезируемый печенью, открыт и описан A. Krause и соавт. [11] как LEAP – liver expressed antimicrobial peptide. Установлено, что гиперпродукция интерлейкина-6 способствует повышенному синтезу гепсидина. Циркулируя в плазме, гепсидин взаимодействует с транспортным белком ферропортином, подавляет всасывание железа в кишечнике, высвобождение его и макрофагов из депо, что приводит к дефициту железа в костном мозге и развитию анемии [12]. При том, что количество железа в организме может быть достаточным и даже повышенным, возникает так называемый функциональный дефицит железа (ФДЖ) [13, 14].
Таким образом, существует дефицит железа абсолютный и функциональный. Функциональный дефицит железа характеризуется нормальным или высоким уровнем ферритина в сыворотке (<800 нг/мл), насыщением трансферрина <20%, увеличением пропорции гипохромных эритроцитов и ретикулоцитов, низким уровнем среднего объема эритроцитов (MCV <80 fl), низким содержанием гемоглобина в эритроците (МСН <27 pg). Может возникать в результате возросших потребностей костного мозга в железе после стимуляции эритропоэза ЭПО.
Абсолютный дефицит железа у онкологических больных может развиваться в результате недостаточного поступления с пищей и недостаточной его абсорбции в желудочно-кишечном тракте, а также повышенной потребности организма при ряде клинических ситуаций (хирургическое вмешательство, желудочно-кишечное кровотечение и др.) Развитию железодефицитной анемии предшествуют стадии простого дефицита железа и железодефицитного эритропоэза. Простой дефицит железа характеризуется сниженной концентрацией ферритина в сыворотке (<30 нг/мл) и железа в костном мозге при нормальном уровне гемоглобина. Клинически отмечается утомляемость, снижение работоспособности, изменение настроения и ухудшение когнитивной функции. Железодефицитный эритропоэз развивается при дефиците железа, доступного для включения в протопорфириновую группу гемоглобина. Отмечается снижение уровня гемоглобина, низкий уровень железа в сыворотке, увеличение свободного протопорфирина в эритроцитах, повышение общей железосвязывающей способности сыворотки, низкое насыщение трансферрина (<15%). Железодефицитная анемия характеризуется снижением запасов железа, низким уровнем железа в сыворотке, повышением общей железосвязывающей способности сыворотки, очень низким уровнем насыщения трансферрина железом и снижением уровня гемоглобина [15].
В онкологии лечение анемии при абсолютном дефиците начинают с применения препаратов железа. При функциональном дефиците железа их сочетают со стимуляторами эритропоэза. При уровне ферритина >800 мг/мл и насыщении трансферрина – 20% препараты железа не вводятся.
В клинической практике для внутривенного введения используются следующие препараты: карбоксимальтозат железа (феринжект), сахарат железа (венофер), глюконат железа (ферлицит), декстран железа (феррумлек, космофер). Все они представляют собой сферические железо-углеводные коллоидные комплексы, включающие железо-(111)-оксигидроксидное ядро, сходное по структуре с ферритином, которое покрыто углеводной оболочкой. Оболочка придает комплексу стабильность и замедляет выделение железа. Эффективность и переносимость внутривенных препаратов зависят от состава оболочки, молекулярной массы и стабильности комплекса. Глюконаты имеют низкую молекулярную массу, менее стабильны и быстрее высвобождают железо: период полувыведения (Т½) – 1 ч. Декстраны имеют большую молекулярную массу, более стабильны – Т½ – 30-60 ч, но наиболее часто дают аллергические реакции, включая анафилактический шок. Сахараты имеют Т½ – 5,3 ч, значительно реже дают аллергические реакции.
Карбоксимальтозат железа (феринжект) характеризуется медленным физиологическим высвобождением железа из стабильного комплекса с углеводом, что определяет его низкую токсичность. Феринжект после внутривенного ведения захватывается ретикулоэндотелиальной системой и распределяется на железо и карбоксимальтозу. После однократного внутривенного введения препарата в дозах от 100 до 1000 мг максимальная его концентрация в сыворотке (37-333 мкг/мл) достигается через 15 мин – 1,21 ч. Время полувыведения составляет 7-12 ч, среднее время удержания в организме 11-12 ч. Препарат практически не выделяется почками. Феринжект вводится внутривенно струйно в максимальной дозе 200 мг не более 3 раз в неделю или в дозе 1000 мг внутривенно капельно 15 мин не чаще 1 раза в неделю. Препарат хорошо переносится и не требует проведения тест-дозы, возможность возникновения аллергических реакций минимальна [16].
Таким образом, больные со злокачественными опухолями часто страдают анемией, которая может быть железодефицитной. Для лечения этих состояний используют средства, стимулирующие эритропоэз и гемотрансфузии. Одновременно необходимо возмещение дефицита железа.
Впервые эффективность комбинации ЭПО с препаратами железа была выявлена в нефрологии, причем было установлено преимущество именно внутривенных форм железа по сравнению с пероральными. В последнее десятилетие проведен ряд исследований по оценке такого лечения у онкологических больных с анемией, индуцированной химиотерапией. Результаты некоторых из них представлены ниже.
В исследовании М. Auerbach и соавт. [17] 157 пациентов, получавших эритропоэтин альфа еженедельно в течение 6 нед, были рандомизированы на три группы: 1-я – дополнительно вводился декстран железа внутривенно струйно или капельно; 2-я – получала препарат железа внутрь, 3-я – была контрольной. Все пациенты имели исходный уровень НЬ<105 г/л и низкое насыщение трансферрина <19%. При оценке через 6 нед лечения в контрольной группе средний уровень НЬ <105 г/л (анемия сохраняется), во 2-й группе НЬ – 112 г/л, целевой уровень не достигнут, существенной разницы с контролем нет. В 1-й группе достигнут максимальный уровень гемоглобина – 119-122 г/л, отличий при струйном и капельном введении нет. Дополнительно оценивали частоту гематологического ответа – процент больных, достигших уровень НЬ >120 г/л или имевших увеличение НЬ >20 г/л. Гематологический ответ достоверно превышал показатели 2-й группы и контроля: 68, 36 и 25% соответственно (р<0,01).
В исследовании D. Henry и соавт. [18] 187 пациентов получали лечение эритропоэтином альфа 1 раз в неделю в течение 12 нед. Из них 129 были рандомизированы на три группы: 1-я – получала дополнительно глюконат железа внутривенно; 2-я – сульфат железа внутрь; 3-я – была контрольной. Включались больные с исходным уровнем НЬ <110 г/л и насыщением трансферрина <15%. При оценке через 8 нед лечения прирост уровня НЬ в 1-й группе составил 24 г/л, а во 2-й и 3-й – 16-15 г/л. Гематологический ответ в 1-й группе составил 73%, во 2-й и 3-й группе соответственно 45 и 41%. Разница статистически достоверна как между 1-й и 2-й группами (р=0,009), так и между 1-й и контролем (р=0,0044).
В 2008 г. L. Bastit и соавт. [19] опубликовали результаты крупного (n=396) открытого рандомизированного исследования III фазы. Пациенты с исходным уровнем НЬ <105 г/л и насыщением трансферрина >15% получали лечение дарбэпоэтином альфа по 500 мкг 1 раз в 3 нед в течение 16 нед. Сравнивались две группы: исследовательская – дополнительно внутривенно 1 раз в неделю вводился сахарат железа; контрольная – железо вводилось перорально или не вводилось. Частота гематологического ответа в исследовательской группе составила 86%, а в контрольной – 73%. Дополнительно оценивалась потребность в заместительных гемотрансфузиях, которая в группе комбинированного лечения достоверно различалась с контролем (9% против 20% соответственно, р=0,005).
В исследовании P. Pedrazzoli и соавт. [20] 149 больным дарбэпоэтин вводился по 150 мкг 1 раз в неделю с внутривенным железом или без него. Авторы показали достоверное преимущество комбинированного лечения с включением внутривенного железа. Интересные данные получили М. Hedenus и соавт. [21], оценившие не только гематологический ответ, но и количество израсходованного ЭПО. Было установлено, что комбинированное применение ЭПО с внутривенным железом в среднем на 25% снижает расход ЭПО по сравнению с контролем.
В литературе имеются публикации, указывающие на возможность достижения целевого уровня гемоглобина и снижения потребности в гемотрансфузиях у онкологических больных с анемией, при использовании только внутривенных форм железа. В 2010 г. Р. Dangsuvan и соавт. [22] опубликовали результаты локального исследования (n=44), в котором сравнивался сахарат железа и пероральные препараты у пациенток с анемией на фоне химиотерапии без дополнительного введения ЭПО. Потребность в заместительных гемотрансфузиях в группе внутривенного сахарата железа составила 22,7%, с пероральным препаратом железа – 63,6%. Опубликованы данные, показавшие эффективность внутривенных препаратов железа для лечения анемии у онкологических больных без применения средств, стимулирующих эритропоэз. В 2010 г. Т. Steinmetz и соавт. [23] опубликовали результаты исследования по оценке эффективности и переносимости карбоксимальтозата железа у онкологических больных с анемией и абсолютным или функциональным дефицитом железа. Оценка эффективности проведена у 420 пациентов, которые были рандомизированы в группу внутривенного железа без средств стимулирующих эритропоэз (n=347), и группу, получавших этот же препарат в комбинации со стимуляторами эритропоэза (n=73). Через 5 нед лечения гемоглобин в обеих группах повысился до 11-12 г/л. Нежелательные явления (в основном тошнота и диарея), возможно, связанные с карбоксимальтозатом железа, составили 2,3%. Препарат в обоих случаях эффективно повышал и стабилизировал уровень гемоглобина у онкологических больных [23].
Заключение
Анемия часто встречается у больных со злокачественными новообразованиями и связана как с основным заболеванием, так и с его лечением: цитотоксическая и лучевая терапия оказывают прямое подавляющее действие на кроветворение. Анемия при злокачественных опухолях по патогенезу ассоциируется с анемией при хронических заболеваниях и нередко сочетается с дефицитом железа – функциональным или абсолютным. Результаты международных исследований показали необходимость использования внутривенных форм железа с гемостимулирующей терапией ЭПО для лечения анемии, возникшей на фоне химиотерапии. Одновременно существуют указания на эффективность внутривенного железа в монотерапии при функциональном его дефиците. Это явилось основанием для включения в международные рекомендации (NCCN, ESMO) по проведению гемостимулирующей терапии у онкологических больных внутривенных форм железа [15, 24]. При отсутствии дефицита железа (ферритин >800 нг/мл и насыщение трансферрина >20%) вводить его не рекомендуется, как и пациентам с признаками активной инфекции [15]. Целевой уровень гемоглобина при лечении анемии не должен превышать 12,0 г/дл (120 г/л), его достижение сопровождается улучшением качества жизни пациентов и, возможно, результатов противоопухолевого лечения и выживаемости. Надеемся, что дальнейшее проведение хорошо спланированных международных исследований позволит ответить на многие вопросы, еще существующие в этой проблеме.
Недавно в клинической практике появился новый препарат для внутривенного введения – железа карбоксимальтозат (феринжект), показавший высокую эффективность как в комбинации с ЭПО, так и в монорежиме. Феринжект не требует проведения тест-дозы, обладает хорошей переносимостью и минимальным риском развития аллергических реакций.
Список использованной литературы
- Ludwig H, Van Bells S, Barret-Lee P. et al. The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur. J. Cancer. 2004; 40: 2293-306.
- Caro J.J., Salas M., Ward A. et al. Anemia as an independent prognostic factor for survival in patients with cancer: a systemic, quantitative review. Cancer. 2001; 91: 2214-21.
- Khorana A., Francis C., Blumberg N. et al. Blood transfusions, thrombosis and mortality in hospitalized patients with cancer. Arch. Intern. Med. 2008; 168: 2377-81.
- Bohlius J., Wilson J., Seidenfeld J. et al. Recombinant human erythropoietins and cancer patients: update meta-analysis of 57 studies including 9353 patients. J. Natl. Cancer Inst. 2006; 98: 708-14.
- Абрамов М.Е. Анемия на фоне химиотерапии. Пути коррекции. Фарматека. 2012; 8: 50-4.
- Птушкин В.В. Анемия в онкологии: подходы к лечению. Современная онкология. 2012; 14 (1): 58-63.
- Aapro M., Osterborg A., Gasco P. et al. Prevalence and management of cancer-related anaemia, iron deficiency and the specific role of i.v.iron. Ann. Oncol. 2012. doi: 10.1093/annonc/mds112.
- Павлов А.Д., Морщакова Е.Ф., Румянцева А.Г. Анемия при злокачественных новообразованиях: патогенез и лечение рекомбинантными человеческим эритропоэтином. Современная онкология. 2002; 4: 50-4.
- Duhrsen U., Augener W., Zwingers T., Brittinger G. Spectrum and frequency of autoimmune derangements in lymphoproliferative disorders: analysis of 637 cases and comparison with myeloprolif-erative diseases. Br. J. Haematol. 1987; 67 (2): 235-9.
- De Rienzo D.P., Saleem A. Anemia of chronic disease: a review of pathogenesis. Tex. Med. 1990; 86: 80-3.
- Krause A., Neitz S., Magert H. et al. LEAP-1, a novel highly disul-de-bonded human peptide, exhibits antimicrobial activity. FEBS Letters. 2000; 480: 147- 50.
- Park C.H., Valore E.V., WaringA.J., Ganz T. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J. Biol. Chem. 2001; 276: 7806-10.
- Милованов Ю.С., Милованова Л.Ю., Козловская Л.В. Нефрогенная анемия: патогенез, прогностическое значение, принципы лечения. Клиническая нефрология. 2010; 6: 7-18.
- Дворецкий Л.И. Железодефицитная анемия в практике терапевта. Русский медицинский журнал. 2009; 23: 1517-21.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Cancer- and chemotherapy-induced Anemia. Version 2.2012 (R).www.NCCN.org.
- Crichton R., Danielson G., Geisser P. Iron therapy with special emphasis on intravenous administration. Science. 2008; 1-127.
- Auerbach M., Ballard H., Trout R. et al. Intravenous iron optimizes the response to recombinant human erythropoietin in cancer patients with chemotherapy-related anemia: a multicenter, open-label, randomized trial. J. Clin. Oncol. 2004; 22: 1301-7.
- Henry D.H., Dahl N.V., Auerbach M. et al. Intravenous ferric gluconate improves response to epoetin alfa versus oral iron or no iron in anemic patients with cancer receiving chemotherapy. Oncologist. 2007; 12: 231-42.
- Bastit L., Vandebroek A., Altintas S. et al. Randomized, multi-center, controlled trial comparing the efficacy and safety of darbepoetin alfa administered every 3 weeks with or without intravenous iron in patients with chemotherapy-induced anemia. J. Clin. Oncol. 2008; 26: 1611-8.
- Pedrazzoli P., Farris A., Del Prete S. et al. Randomized trial of intravenous iron supplementation in patients with chemotherapy-related anemia without iron deficiency treated with darbepoetin alfa. J. Clin. Oncol. 2008; 26: 1619-25.
- Hedenus M., Birgegard G., Nasman P. et al. Addition ofintravenous iron to epoetin beta increases hemoglobin response and decreases epoetin dose requirement in anemic patients with lymphoprolif-erative malignancies: a randomized multicenter study. Leukemia. 2007; 21: 627-32.
- Dangsuwan P., Manchana T. Blood transfusion reduction with intravenous iron in gynecologic cancer patients receiving chemotherapy. Gynecol. Oncol. 2010; 116 (3): 522-25.
- Steinmetz T., Tschechne B., Virgin G. Ferric Carboxymaltose for the Correction of Cancer- and Chemotherapy-Induced Anaemia in Clinical Practice. J. Support Cancer Care. 2010; 19: 261.
- Schrijvers D., de Samblanx H., Roila F. Erythropoiesis-stimulating agents in the treatment of anaemia in cancer patients: ESMO Clinical Practice Guidelines for use. Ann. Oncol. 2010; 21: S 5: v244-v247, doi: 10.1093/annonc/mdq202.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Рак желудка – злокачественная опухоль, которая развивается из клеток слизистой оболочки желудка. По распространенности он занимает пятое место среди всех видов рака. Как правило, болеют люди старше 40 лет. Основной метод лечения – хирургический, удаление всего желудка или его пораженной части.
Причины рака желудка
Точные причины рака желудка неизвестны. В слизистой оболочке органа возникают мутации ДНК, и получаются «неправильные» клетки, которые могут приобрести способность к неконтролируемому росту. Почему это происходит — не совсем понятно. Зато хорошо изучены факторы риска — условия, которые повышают риск рака желудка.
Наследственность и рак желудка
Некоторые люди носят в себе «бомбу замедленного действия», спрятанную в генах. Иногда даже не одну. Это подтверждается некоторыми фактами:
- Если у близкого родственника (родители, братья, сестры, дети) человека диагностирован рак желудка, его риски повышены примерно на 20%.
- Мужчины болеют чаще, чем женщины. Сложно сказать, с чем конкретно это связано, но можно предположить, что замешана разница между мужскими и женскими генами.
- Японцы, которые мигрировали в США, болеют раком желудка реже соотечественников, но чаще, чем «коренные» американцы. Это говорит о том, что дело не только в характере питания, но и в наследственности. Главный подозреваемый — ген под названием RNF43.
- Карцинома — самый распространенный тип рака желудка — чаще встречается у людей с группой крови A (II), которую они, конечно же, получили вместе с генами.
- Риски повышены при некоторых наследственных заболеваниях: злокачественной анемии (в 3-6 раз), гипогаммаглобулинемии, неполипозном раке толстой кишки.
- Заболеваемость раком желудка повышается после 70 лет: считается, что это происходит из-за того, что с возрастом в клетках тела накапливаются нежелательные мутации.
Рак желудка и характер питания
Роль питания в возникновении злокачественных опухолей желудка изучена хорошо. Риски повышает большое количество соли, крахмала, нитратов, некоторых углеводов. Чаще болеют люди, которые едят много соленых, копченых, маринованных продуктов, мало овощей и фруктов.

Рак желудка и вредные привычки
Курение повышает риск рака желудка примерно вдвое. Ученые в Великобритании считают, что примерно каждый пятый случай связан именно с курением. Когда человек вдыхает табачный дым, часть его попадает в желудок, и содержащиеся в нем вредные вещества повреждают клетки слизистой оболочки. Риски тем выше, чем больше стаж курильщика и ежедневное количество сигарет. Алкоголь тоже в списке подозреваемых, но прямых доказательств пока нет.
Хеликобактер пилори (H. Pylori) и рак желудка
H. Pylori — бактерия, которая способна вызывать язвенную болезнь и хронический атрофический гастрит. В настоящее время она считается важным фактором развития рака желудка. При хеликобактерной инфекции вероятность возникновения злокачественной опухоли в желудке повышается в 4 раза. В половине удаленных опухолей обнаруживают этого возбудителя.
Другие факторы риска
- Язвенная болезнь. Данные исследований по этому поводу противоречивы. Если язва находится в теле желудка, риск рака повышается почти в 2 раза. При язве нижнего отдела риски, видимо, не повышаются.
- Аденоматозные полипы слизистой оболочки.
- Семейный аденоматозный полипоз – заболевание, вызванное мутацией в гене APC и приводящее к возникновению множества полипов в желудке, кишечнике. При этом незначительно повышается риск рака.
- Перенесенные на желудке операции повышают риск рака в 2,5 раза. Это происходит из-за того, что желудок производит меньше соляной кислоты, и в нем активнее размножаются бактерии, продуцирующие нитриты, происходит обратный заброс желчи из тонкой кишки. Обычно злокачественные опухоли возникают спустя 10-15 лет после хирургического вмешательства.
- Социальное и материальное положение: риск увеличивается при низком уровне доходов, проживании в перенаселенной квартире, без удобств, в неблагоприятном районе.
- Другие онкологические заболевания: рак пищевода, простаты, мочевого пузыря, молочных желез, яичников, яичек.
- Болезнь Менетрие (гипертрофическая гастропатия) характеризуется разрастанием слизистой оболочки желудка, появлением в ней складок и снижением продукции соляной кислоты. Патология встречается редко, поэтому неизвестно, как часто она приводит к раку желудка.
- В группе повышенного риска работники угольной, металлургической и резиновой промышленности.
- Иммунодефицит повышает вероятность развития рака, лимфомы желудка.
Классификация рака желудка: каким он бывает?
Злокачественные опухоли желудка, согласно Международной гистологической классификации ВОЗ, делят на 11 типов, в зависимости от того, из каких клеток они происходят. Преобладает рак из железистых клеток, которые выстилают слизистую оболочку и вырабатывают слизь — аденокарцинома. Он составляет 90-95% всех случаев. Также встречаются опухоли из иммунных (лимфома), гормонпродуцирующих (карциноид) клеток, из нервной ткани.
Одна из старейших классификаций делит злокачественные опухоли желудка на 3 типа:
- Кишечный. Как следует из названия, в окружении опухоли имеется кишечная метаплазия, то есть слизистая оболочка желудка становится похожа на слизистую кишечника. Этот тип рака чаще встречается у пожилых людей, отличается более благоприятным прогнозом. Это типично «японский» тип рака.
- Диффузный. Опухолевые клетки расползаются по стенке желудка, они окружены нормальной слизистой оболочкой.
- Смешанный.
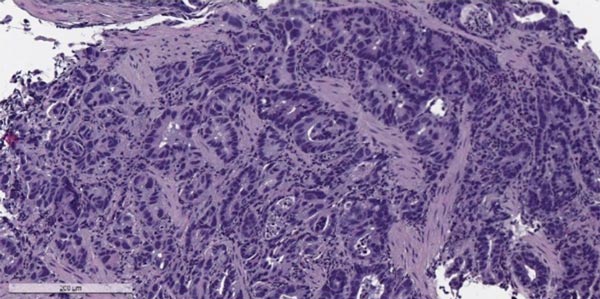
Аденокарцинома желудка
Стадии рака желудка
Рак желудка делят на ранний (начальный) и распространенный. При раннем опухоль не прорастает глубже слизистой оболочки и подслизистой основы. Такие опухоли проще удалить (в том числе эндоскопическим путем), при них лучше прогноз. Также используют классификацию TNM, которая учитывает размеры и прорастание в разные ткани первичной опухоли (T), метастазы в регионарных (близлежащих) лимфатических узлах (N), отдаленные метастазы (M).
Классификация в зависимости от состояния первичной опухоли (T):
- Tx – первичную опухоль невозможно оценить;
- T0 – первичная опухоль не обнаруживается;
- T1 – тяжелая дисплазия клеток слизистой оболочки, опухоль находится в поверхностном слое слизистой оболочки (“рак на месте”);
- T2 – опухоль проросла в мышечный слой стенки органа;
- T3 – рак достиг серозной (наружной) оболочки желудка, но не пророс в нее;
- T4 – опухоль проросла в серозную оболочку (T4a), в соседние структуры (T4b).
Классификация в зависимости от наличия поражения в регионарных лимфатических узлах:
- Nx – невозможно оценить метастазы в лимфатических узлах;
- N0 – метастазы в регионарных лимфоузлах не обнаружены;
- N1 – поражены 1-2 лимфоузла;
- N2 – опухолевые клетки распространились в 3-6 лимфоузлов;
- N3 – метастазы в 7-15 (N3a) или в 16 и более (N3b) лимфоузлах.
Классификация в зависимости от наличия отдаленных метастазов:
- M0 – отдаленные метастазы не обнаружены;
- M1 – обнаружены отдаленные метастазы.
Аденокарциному делят на 4 стадии:
- I стадия (T1M0N0 – стадия Ia; T1N1M0, T2N0M0 – стадия Ib). Опухоль находится в пределах слизистой оболочки и подслизистой основы, не прорастает вглубь стенки желудка. Иногда раковые клетки обнаруживают в близлежащих лимфатических узлах.
- II стадия (T1N2M0, T2N1M0, T3N0M0 – стадия IIa; T1N3aM0, T2N2M0, T3N1M0, T4aN0M0 – стадия IIb). Опухоль прорастает в мышечный слой стенки желудка и распространяется в лимфатические узлы.
- III стадия (T2N3aN0, T3N2M0, T4aN1M0, T4aN2M0 – стадия IIIa; T1N3bM0, T2N3bM0, T3N3aM0, T4aN3aM0, T4bN1M0 – стадия IIIb; T3N3bM0, T4aN3bM0, T4bN3aM0 – стадия IIIc). Рак пророс через всю стенку желудка и, возможно, распространился на соседние органы, успел сильнее поразить близлежащие лимфатические узлы.
- IV стадия (любые T и N, M1). Есть отдаленные метастазы.
Метастазы рака желудка
Раковые клетки могут отрываться от материнской опухоли и мигрировать в другие части тела различными путями:
- С током лимфы они могут попасть в лимфатические узлы брюшной полости, а из них — в лимфоузлы надключичной области — метастаз Вирхова. Метастаз в лимфоузлы, окружающие прямую кишку, называют метастазом Шницлера.
- С током крови раковые клетки чаще всего распространяются в печень, реже — в легкие.
- Также раковые клетки могут рассеиваться по брюшной полости. Если они оседают на яичниках, образуется метастаз Крукенберга, в пупке — метастаз сестры Марии Джозеф.Редко при раке желудка обнаруживают метастазы в головном мозге, костях.
Симптомы: как проявляется рак желудка?
На ранних стадиях рак желудка либо не имеет симптомов вообще, либо маскируется под другие заболевания: гастрит, обострение язвенной болезни. Ухудшение аппетита и боли под ложечкой редко заставляют людей сразу же подозревать онкозаболевание и бежать в больницу. Обычно ограничиваются диетой и приемом разрекламированных таблеток «от желудка». Если человек уже страдает язвенной болезнью, он может воспринять первые признаки рака желудка как очередное обострение язвы. И уже позже, когда диагностировано онкологическое заболевание, больной вспоминает, что проявления были «не такими, как всегда».

Существует так называемый «синдром малых признаков» — его сформулировал один из основоположников советской онкологии, Александр Иванович Савицкий. Если беспокоят похожие симптомы — это повод сходить к врачу и провериться:
- Необъяснимая слабость и повышенная утомляемость.
- Плохой аппетит.
- Снижение работоспособности.
- Потеря веса.
- «Желудочный дискомфорт»: неприятные ощущения, из-за которых даже любимая еда больше не радует.
В дальнейшем нарастают более яркие, «кричащие» признаки. Они зависят от того, в какой части органа находится опухоль:
- Дисфагия. Возникает, если новообразование сдавливает место перехода желудка в пищевод. Сначала становится сложно глотать твердую пищу, затем и жидкую.
- Рвота недавно съеденной пищей. Характерна для опухолей в нижней части желудка, в месте перехода в двенадцатиперстную кишку.
- Стойкая изжога.
- Постоянные боли в области желудка, которые отдают в спину. Они не проходят ни днем, ни ночью.
- Потеря веса.
- Увеличение живота. Возникает из-за асцита — скопления жидкости в брюшной полости.
- Под ложечкой можно почувствовать и нащупать жесткое выпирающее образование. Это — опухоль, которая срослась с передней брюшной стенкой.
Со временем в опухоли начинаются процессы изъязвления и распада, развивается желудочное кровотечение. Проявляется оно в виде черного дегтеобразного стула, рвоты, которая выглядит как «кофейная гуща» или содержит примеси алой крови. Если человек теряет много крови, он становится бледным, возникает слабость, головокружение. У некоторых людей рак диагностируется, когда их приводят в клинику в таком состоянии на машине «Скорой помощи».
Как вовремя диагностировать заболевание? Что такое скрининг, и почему он важен?
Статистика говорит о том, что в 75% случаев рак желудка диагностируют уже на распространенной стадии, когда опухоль успевает прорасти в соседние ткани, дать метастазы. Лечить таких больных сложно, прогноз, как правило, неблагоприятный. Обычно выраженные симптомы говорят о том, что рак уже успел распространиться по организму.
Как проверить желудок на рак: на ранних стадиях помогает скрининг — регулярные обследования людей, которые не испытывают никаких симптомов. В качестве скринингового исследования применяют гастроскопию — эндоскопическое исследование, во время которого в желудок вводят гибкую трубку с миниатюрной видеокамерой и лампочкой на конце. Насколько эффективна гастроскопия? Лучше всего это демонстрирует японский опыт. Распространенность рака желудка в Японии очень высока, а смертность от него одна из самых низких в мире. Достичь этого удалось благодаря внедрению массового скрининга.
В Европейской онкологической клинике существуют специальные скрининговые программы, которые помогают вовремя диагностировать разные онкологические заболевания. Посетите врача, узнайте о своих рисках и получите индивидуальные рекомендации по поводу скрининга.
Какие методы диагностики может назначить врач?
Помимо гастроскопии, программа диагностики рака желудка может включать:
- Рентгенографию, перед которой пациенту дают выпить контрастный раствор. При этом контуры желудка хорошо видны на снимках.
- Компьютерную томографию, позитронно-эмиссионную томографию.
- Диагностическую лапароскопию. Это операция, во время которой в живот пациента через отверстия вводят лапароскоп с миниатюрной видеокамерой и специальные инструменты. Процедура помогает оценить, как далеко за пределы желудка успел распространиться процесс.
- Биопсию. Врач получает образец подозрительной ткани и отправляет в лабораторию для изучения под микроскопом. Этот метод диагностики помогает максимально точно диагностировать онкологическое заболевание и установить тип рака. Биопсию можно провести во время гастроскопии, хирургического вмешательства.
Современные принципы лечения рака желудка
Основной метод лечения рака желудка — хирургический. Объем операции зависит от того, на какой стадии обнаружена опухоль. Если она не успела распространиться вглубь стенки органа, проводят эндоскопическую резекцию — удаление пораженного участка при помощи инструмента, введенного через рот, как во время гастроскопии.
При субтотальной гастрэктомии удаляют часть органа, пораженную опухолевым процессом. На более поздних стадиях орган приходится удалять целиком вместе с окружающими тканями. При этом пищевод соединяют с тонкой кишкой. Если лимфатические узлы в брюшной полости поражены метастазами, их также нужно удалить.
В запущенных случаях, когда излечение невозможно, проводят паллиативную операцию. Хирург удаляет пораженную часть желудка, чтобы облегчить состояние пациента.
Лучевая терапия при раке желудка бывает:
- неоадъювантной — проводится перед операцией, чтобы уменьшить размеры опухоли и облегчить её удаление;
- адъювантной — чтобы уничтожить раковые клетки, которые остались в организме после операции.
Наиболее распространенные побочные эффекты лучевой терапии при облучении области живота: тошнота, нарушение пищеварения, диарея.
Химиотерапия также бывает адъювантной и неоадъювантной. Часто её сочетают с лучевой терапией. Химиолучевая терапия может стать основным методом лечения при метастатическом раке на поздних стадиях, когда прогноз неблагоприятный, но есть возможность облегчить симптомы и продлить жизнь больного.
В некоторых случаях эффективны таргетные препараты: трастузумаб, рамуцирумаб, иматиниб, сунитиниб, регорафениб. Но они подходят лишь в тех случаях, когда опухолевые клетки обладают определенными молекулярно-генетическими свойствами.
Какой прогноз при раке желудка?
Прогноз при раке желудка зависит от стадии опухоли, на которой был установлен диагноз и начато лечение. Шансы на стойкую ремиссию наиболее высоки, если опухоль не проросла за пределы слизистой оболочки и подслизистой основы. При метастазах прогноз, как правило, неблагоприятен.
В онкологии существует такой показатель, как пятилетняя выживаемость. Он показывает, какой процент больных остаются живы в течение 5-ти лет. Срок достаточно большой, в определенном смысле его можно приравнять к выздоровлению. Пятилетняя выживаемость при разных стадиях рака желудка составляет:
- I стадия — 57-71%;
- II стадия — 33-46%;
- III стадия — 9-20%;
- IV стадия — 4%.
Некоторые цифры и факты:
- Эксперты Всемирной организации здравоохранения (ВОЗ) утверждают, что ежегодно от рака желудка во всем мире погибают 754 000 людей.
- В XXI веке распространенность заболевания снижается, но в разных странах неодинаково. Так, на одного больного из Великобритании приходится двое из России и трое из Японии.
- По распространенности среди прочих онкозаболеваний рак желудка занимает пятое место, но среди причин смерти — третье.
- Одна из лидирующих стран по распространенности рака – Япония, во многом за счет характера питания.
В Европейской онкологической клинике применяются наиболее современные методы лечения рака желудка и других онкологических заболеваний. Даже если прогноз неблагоприятен, это не означает, что больному ничем нельзя помочь. Наши врачи знают, как облегчить симптомы, обеспечить приемлемое качество жизни, продлить жизнь
Цены на лечение рака желудка на 1-4 стадиях в Европейской онкологической клинике
- Консультация онколога — 5100 руб.
- Лечение рака желудка — от 60000 руб.
- Проведение внутриплевральной химиотерапии (инфузия, без стоимости лекарственных препаратов) — 21900 руб.
- Проведение иммунотерапии (без стоимости лекарственных препаратов) — 17200 руб.
Источник
