Что такое диссеминированный рак желудка
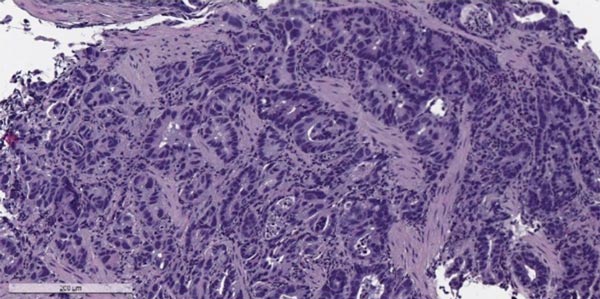
В статье представлены результаты клинического наблюдения за больным диссеминированным раком желудка. Химиотерапия оказалась эффективной и позволила достичь полной регрессии отдаленных метастазов и длительной ремиссии болезни. От предложенного хирургического лечения пациент отказался, в связи с чем ему была продолжена поддерживающая химиотерапия в течение 18 месяцев. Спустя два года после ее завершения зарегистрировано прогрессирование болезни в виде метастазов в легких, лимфатических узлах средостения. Химиотерапия была возобновлена. Продолжительность жизни больного к сентябрю 2016 г. составила 57 месяцев, выживаемость без прогрессирования болезни на первой линии химиотерапии – 48 месяцев, длительность частичной ремиссии – 46 месяцев. На фоне возобновления трехкомпонентного режима первой линии в современной модификации в качестве терапии второй линии также была достигнута и подтверждена частичная регрессия опухоли. Продолжительность жизни пациента с момента начала химиотерапии второй линии превышает девять месяцев.
Введение
Рак желудка занимает лидирующие позиции в структуре онкологической заболеваемости и смертности как в России, так и за рубежом. Ежегодно в мире выявляют свыше 1 млн новых случаев заболевания, около 700 000 больных умирают [1]. В России рак желудка на протяжении многих лет занимает второе место в структуре смертности от онкологических заболеваний [2].
Согласно статистике, на момент установления диагноза операбельный процесс выявляется лишь у 20% пациентов, более чем у половины больных отмечаются отдаленные метастазы.
Тактика лечения
В настоящее время стандартным методом лечения больных диссеминированным раком желудка является лекарственная терапия. Химиотерапия позволяет увеличить продолжительность жизни до одного года при выживаемости без прогрессирования заболевания до шести месяцев и более, а также устранить или облегчить симптомы, связанные с опухолью, и тем самым улучшить качество жизни пациентов [3]. Сравнительный анализ эффективности двух- и трехкомпонентных режимов химиотерапии показал статистически достоверное увеличение продолжительности жизни больных при использовании трехкомпонентных комбинаций [4, 5].
Одной из наиболее эффективных схем химиотерапии при диссеминированном раке желудка признана комбинация DCF (доцетаксел + цисплатин + 5-фторурацил (5-ФУ) в режиме суточных инфузий) [6]. Однако ее применение ограничено высокой токсичностью. Так, нейтропения 3–4-й степени наблюдается у 82% больных, в том числе у 29% лечение сопровождается фебрильной лихорадкой.
С 1996 г. в отделении химиотерапии РОНЦ им. Н.Н. Блохина было начато изучение эффективности и токсичности доцетаксела в составе трехкомпонентных режимов в качестве первой линии химиотерапии при неоперабельном раке желудка. Первая изучаемая оригинальная комбинация включала Таксотер 75 мг/м² во второй день, цисплатин 75 мг/м² во второй день, 5-ФУ по 500 мг/м² в виде трехчасовой инфузии в первый – третий дни (режим TPF) [7–9]. В одной из последующих модификаций режима цисплатин был заменен на оксалиплатин. Химиотерапию по схеме «Таксотер 75 мг/м2 во второй день, Элоксатин 100 мг/м2 во второй день, лейковорин 50 мг внутривенно струйно с последующим введением 5-ФУ в дозе 500 мг/м2 внутривенно капельно в течение трех часов в первый, второй, третий дни каждые 21 день (TOFL)» получили 39 пациентов. Объективный эффект зарегистрирован у 19 (48,7%) больных, стабилизация болезни – у 14 (35,9%), прогрессирование заболевания – у шести (15,4%). Медиана выживаемости без прогрессирования составила 6,5 месяца, медиана общей продолжительности жизни – 14,9 месяца. Токсичность режима TОFL была умеренной.
Полная регрессия отдаленных метастазов зафиксирована у трех пациентов. Двум из них после достижения полной регрессии отдаленных метастазов по брюшине была выполнена паллиативная операция в объеме гастрэктомии с лимфодиссекцией D2. Продолжительность жизни этих пациентов составила 16 и более 31 месяца. Третий пациент после констатации полной регрессии отдаленных метастазов от хирургического лечения отказался, и ему была продолжена поддерживающая химиотерапия. Приводим выписку из его истории болезни.
Клинический случай
Больной М. 53 лет обратился в РОНЦ им. Н.Н. Блохина в ноябре 2011 г. с жалобами на нарушение прохождения пищи по пищеводу (дисфагия 2-й степени), снижение веса на 10 кг в течение пяти месяцев.
При эзофагогастродуоденоскопии (ЭГДС) выявлена бугристая опухоль, исходящая из желудка, распространяющаяся на пищевод, с проксимальной границей инфильтрации на уровне 35 см от резцов. Опухоль циркулярно охватывала стенки пищевода, деформируя и суживая его просвет до 1 см. Эндоскоп с трудом был введен в желудок, где на уровне субкардиального отдела визуализирована дистальная граница опухоли. Розетка кардии циркулярно занята изъязвленной опухолью, стенки ригидные, несмыкаемые. Гистологическое заключение: аденокарцинома.
Ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства показало наличие множественных метастатически измененных лимфатических узлов в забрюшинном пространстве от уровня эпигастрия до бифуркации аорты размером 3,8 × 1,5 см. В шейно-надключичной области слева визуализировались множественные лимфатические узлы до 1,7 × 1,3 см (метастазы), справа – до 1,2 × 0,5 см.
Результаты магнитно-резонансной томографии брюшной полости: конгломерат увеличенных парагастральных лимфатических узлов общим размером до 5,5 × 4,5 см, увеличенные парааортальные, паракавальные и аортокавальные лимфатические узлы размером до 3,5 см. Утолщение стенок желудка. Асцит отсутствовал.
Диагностирован рак проксимального отдела желудка с переходом на пищевод (аденокарцинома) с метастазами в надключичные лимфатические узлы слева, забрюшинные лимфатические узлы, стадия IV, сTхNxM1.
Сопутствующие заболевания отсутствовали.
С декабря 2011 г. по май 2012 г. проведено восемь курсов химиотерапии по схеме TOFL: доцетаксел 75 мг/м² во второй день + оксалиплатин 100 мг/м² во второй день + лейковорин 50 мг внутривенно струйно в первый – третий дни + 5-ФУ 500 мг/м² в первый – третий дни в виде трехчасовой инфузии. Значимых побочных явлений в ходе лечения не зарегистрировано.
На фоне терапии жалобы на дисфагию полностью исчезли после первого курса, пациент начал прибавлять в весе. При контрольном обследовании после трех курсов отмечалась выраженная положительная динамика. По данным УЗИ перестали определяться забрюшинные и шейно-надключичные лимфатические узлы с обеих сторон. При ЭГДС в пищеводе на уровне 35 см от резцов по заднеправой полуокружности обнаружено плоское изъязвление с подрытыми относительно мягкими краями, от которого плоский инфильтрат в виде продольного участка распространялся до кардии и далее до границы с субкардией. Розетка кардии была эластичная, свободно проходима. Просвет пищевода на уровне опухоли расширился, стенки стали эластичными. При ретрофлексионном осмотре выявлен небольшой участок опухолевой инфильтрации субкардии по задней стенке.
По окончании трех курсов лечения зарегистрирована частичная регрессия опухоли с полной регрессией забрюшинных и надключичных лимфатических узлов. Пациент продолжал получать химиотерапию по прежней схеме.
При обследовании по окончании шести курсов химиотерапии данных о наличии отдаленных метастазов при УЗИ не получено, что было подтверждено результатами компьютерной томографии (КТ) брюшной полости. Данные ЭГДС также подтвердили частичную регрессию опухоли.
В связи с нарастающей положительной динамикой было решено провести еще два курса химиотерапии по прежней схеме.
После завершения восьми курсов химиотерапии при ЭГДС в нижнегрудном отделе пищевода визуализировалась опухоль, которая занимала половину окружности стенки пищевода и половину диаметра просвета за счет экзофитного компонента. Дистальный край опухоли лоцировался на уровне 38 см от резцов, дистальнее на 2 см определялась плоская овальная язва 0,6 × 0,4 см, с выраженной краевой эпителизацией, без признаков неопластической перестройки. Розетка кардии располагалась на уровне диафрагмального сужения (41 см), эластичная, слизистая оболочка в зоне кардии не инфильтрирована.
Таким образом, после восьми курсов химиотерапии, по данным УЗИ и КТ, зарегистрированы полная регрессия отдаленных метастазов и значительное уменьшение первичной опухоли.
Для уточнения распространенности процесса с последующим выбором лечебной тактики на консилиуме с участием хирургов пациенту предложили проведение лапароскопии. Однако и от лапароскопии, и от оперативного лечения он категорически отказался, в связи с чем ему назначили поддерживающую химиотерапию лейковорином по 50 мг внутривенно струйно в первый – третий дни в комбинации с 5-ФУ по 500 мг/м² в виде трехчасовой инфузии в первый – третий дни каждые 21–28 дней. С июня 2012 г. по декабрь 2013 г. проведено 20 курсов поддерживающей химиотерапии на фоне регулярного контрольного обследования каждые три курса.
При регулярном УЗИ периферических лимфоузлов, органов брюшной полости, забрюшинного пространства и таза в процессе поддерживающего лечения данных о метастазировании процесса не получено. При ЭГДС определялось лишь изъязвление в пищеводе на уровне 36 см от резцов размером от 0,5 до 1 см. При неоднократной биопсии слизистой оболочки в зоне изъязвления с последующим морфологическим исследованием биоптатов элементы опухоли не обнаружены. С января 2014 г. больному рекомендовано динамическое наблюдение.
В декабре 2015 г. во время очередного планового обследования при рентгеновской КТ грудной клетки в базальных отделах S2 верхней доли левого легкого у главной междолевой плевры выявлено узловое образование с бугристыми контурами диаметром 1,6 см. Паратрахеально справа определялись лимфатические узлы до 1,2 см в диаметре, паравазально и в аортопульмональном окне – множественные лимфоузлы до 0,9 см, в области бифуркации трахеи – конгломерат лимфатических узлов до 4,3 × 2,7 см. Корень левого легкого несколько расширен, в нем также определялись увеличенные лимфатические узлы размером до 1,5 см. Результаты рентгеновской КТ: метастатическое поражение легкого, лимфатических узлов средостения и корня легкого. При ЭГДС динамики не зафиксировано, по-прежнему по задней полуокружности в области кардиоэзофагеального перехода определялось изъязвление, при гистологическом исследовании биопсийного материала – лейкоцитарно-некротические массы и мелкий кусочек грануляционной ткани.
Изменения, выявленные при рентгеновской КТ органов грудной клетки, были расценены как метастатические, констатировано прогрессирование рака желудка и возобновлена химиотерапия по схеме FLOT в виде реиндукции.
С декабря 2015 г. по апрель 2016 г. проведено девять курсов химиотерапии. Лечение больной переносил удовлетворительно.
При обследовании после шестого курса зарегистрирована частичная регрессия опухоли: образование в базальных отделах S2 верхней доли левого легкого практически перестало определяться (на его месте сохранялось небольшое уплотнение легочной ткани). Конгломерат лимфатических узлов в области бифуркации трахеи уменьшился вдвое: с 4,3 × 2,7 см до 2,2 × 1,1 см. Лимфатические узлы средостения уменьшились на 50%, лимфатические узлы корня левого легкого – с 1,5 см до 0,8 см.
При обследовании после девяти курсов химиотерапии в мае 2016 г. частичная регрессия сохранялась. Пациенту рекомендовано динамическое наблюдение.
Таким образом, в результате химиотерапии доцетакселом, оксалиплатином и 5-ФУ продолжительность жизни больного исходно диссеминированным раком желудка к сентябрю 2016 г. составила 57 месяцев, выживаемость без прогрессирования заболевания на первой линии химиотерапии – 48 месяцев, длительность частичной ремиссии – 46 месяцев. Эффективным оказалось и возобновление трехкомпонентного режима первой линии в современной модификации в качестве терапии второй линии, на фоне которой также была достигнута и подтверждена частичная регрессия опухоли. Продолжительность жизни пациента с момента начала химиотерапии второй линии превышает девять месяцев.
Заключение
К сожалению, на современном этапе развития медицины мы не можем спрогнозировать ни эффективность определенного режима химиотерапии у конкретного больного диссеминированным раком желудка, ни вероятность достижения длительной ремиссии. Выбор химиотерапии обычно осуществляется эмпирически. Однако появление эффективных режимов химиотерапии при диссеминированной аденокарциноме желудка или кардиоэзофагеального перехода позволило существенно улучшить результаты лечения данной категории пациентов.
Представленное клиническое наблюдение демонстрирует возможность достижения длительной ремиссии на фоне применения современной трехкомпонентной химиотерапии с включением доцетаксела и оксалиплатина, а также ставит перед врачами новые тактические вопросы. Одним из них является вопрос о целесообразности подключения хирургического лечения в случае полной регрессии отдаленных метастазов на фоне эффективной химиотерапии.
Данное наблюдение свидетельствует также о том, что при прогрессировании диссеминированного рака желудка после длительной ремиссии целесообразна реиндукция той же схемы химиотерапии, при использовании которой был получен первый выраженный эффект.
Источник
Рак желудка – злокачественная опухоль, которая развивается из клеток слизистой оболочки желудка. По распространенности он занимает пятое место среди всех видов рака. Как правило, болеют люди старше 40 лет. Основной метод лечения – хирургический, удаление всего желудка или его пораженной части.
Причины рака желудка
Точные причины рака желудка неизвестны. В слизистой оболочке органа возникают мутации ДНК, и получаются «неправильные» клетки, которые могут приобрести способность к неконтролируемому росту. Почему это происходит — не совсем понятно. Зато хорошо изучены факторы риска — условия, которые повышают риск рака желудка.
Наследственность и рак желудка
Некоторые люди носят в себе «бомбу замедленного действия», спрятанную в генах. Иногда даже не одну. Это подтверждается некоторыми фактами:
- Если у близкого родственника (родители, братья, сестры, дети) человека диагностирован рак желудка, его риски повышены примерно на 20%.
- Мужчины болеют чаще, чем женщины. Сложно сказать, с чем конкретно это связано, но можно предположить, что замешана разница между мужскими и женскими генами.
- Японцы, которые мигрировали в США, болеют раком желудка реже соотечественников, но чаще, чем «коренные» американцы. Это говорит о том, что дело не только в характере питания, но и в наследственности. Главный подозреваемый — ген под названием RNF43.
- Карцинома — самый распространенный тип рака желудка — чаще встречается у людей с группой крови A (II), которую они, конечно же, получили вместе с генами.
- Риски повышены при некоторых наследственных заболеваниях: злокачественной анемии (в 3-6 раз), гипогаммаглобулинемии, неполипозном раке толстой кишки.
- Заболеваемость раком желудка повышается после 70 лет: считается, что это происходит из-за того, что с возрастом в клетках тела накапливаются нежелательные мутации.
Рак желудка и характер питания
Роль питания в возникновении злокачественных опухолей желудка изучена хорошо. Риски повышает большое количество соли, крахмала, нитратов, некоторых углеводов. Чаще болеют люди, которые едят много соленых, копченых, маринованных продуктов, мало овощей и фруктов.

Рак желудка и вредные привычки
Курение повышает риск рака желудка примерно вдвое. Ученые в Великобритании считают, что примерно каждый пятый случай связан именно с курением. Когда человек вдыхает табачный дым, часть его попадает в желудок, и содержащиеся в нем вредные вещества повреждают клетки слизистой оболочки. Риски тем выше, чем больше стаж курильщика и ежедневное количество сигарет. Алкоголь тоже в списке подозреваемых, но прямых доказательств пока нет.
Хеликобактер пилори (H. Pylori) и рак желудка
H. Pylori — бактерия, которая способна вызывать язвенную болезнь и хронический атрофический гастрит. В настоящее время она считается важным фактором развития рака желудка. При хеликобактерной инфекции вероятность возникновения злокачественной опухоли в желудке повышается в 4 раза. В половине удаленных опухолей обнаруживают этого возбудителя.
Другие факторы риска
- Язвенная болезнь. Данные исследований по этому поводу противоречивы. Если язва находится в теле желудка, риск рака повышается почти в 2 раза. При язве нижнего отдела риски, видимо, не повышаются.
- Аденоматозные полипы слизистой оболочки.
- Семейный аденоматозный полипоз – заболевание, вызванное мутацией в гене APC и приводящее к возникновению множества полипов в желудке, кишечнике. При этом незначительно повышается риск рака.
- Перенесенные на желудке операции повышают риск рака в 2,5 раза. Это происходит из-за того, что желудок производит меньше соляной кислоты, и в нем активнее размножаются бактерии, продуцирующие нитриты, происходит обратный заброс желчи из тонкой кишки. Обычно злокачественные опухоли возникают спустя 10-15 лет после хирургического вмешательства.
- Социальное и материальное положение: риск увеличивается при низком уровне доходов, проживании в перенаселенной квартире, без удобств, в неблагоприятном районе.
- Другие онкологические заболевания: рак пищевода, простаты, мочевого пузыря, молочных желез, яичников, яичек.
- Болезнь Менетрие (гипертрофическая гастропатия) характеризуется разрастанием слизистой оболочки желудка, появлением в ней складок и снижением продукции соляной кислоты. Патология встречается редко, поэтому неизвестно, как часто она приводит к раку желудка.
- В группе повышенного риска работники угольной, металлургической и резиновой промышленности.
- Иммунодефицит повышает вероятность развития рака, лимфомы желудка.
Классификация рака желудка: каким он бывает?
Злокачественные опухоли желудка, согласно Международной гистологической классификации ВОЗ, делят на 11 типов, в зависимости от того, из каких клеток они происходят. Преобладает рак из железистых клеток, которые выстилают слизистую оболочку и вырабатывают слизь — аденокарцинома. Он составляет 90-95% всех случаев. Также встречаются опухоли из иммунных (лимфома), гормонпродуцирующих (карциноид) клеток, из нервной ткани.
Одна из старейших классификаций делит злокачественные опухоли желудка на 3 типа:
- Кишечный. Как следует из названия, в окружении опухоли имеется кишечная метаплазия, то есть слизистая оболочка желудка становится похожа на слизистую кишечника. Этот тип рака чаще встречается у пожилых людей, отличается более благоприятным прогнозом. Это типично «японский» тип рака.
- Диффузный. Опухолевые клетки расползаются по стенке желудка, они окружены нормальной слизистой оболочкой.
- Смешанный.

Аденокарцинома желудка
Стадии рака желудка
Рак желудка делят на ранний (начальный) и распространенный. При раннем опухоль не прорастает глубже слизистой оболочки и подслизистой основы. Такие опухоли проще удалить (в том числе эндоскопическим путем), при них лучше прогноз. Также используют классификацию TNM, которая учитывает размеры и прорастание в разные ткани первичной опухоли (T), метастазы в регионарных (близлежащих) лимфатических узлах (N), отдаленные метастазы (M).
Классификация в зависимости от состояния первичной опухоли (T):
- Tx – первичную опухоль невозможно оценить;
- T0 – первичная опухоль не обнаруживается;
- T1 – тяжелая дисплазия клеток слизистой оболочки, опухоль находится в поверхностном слое слизистой оболочки (“рак на месте”);
- T2 – опухоль проросла в мышечный слой стенки органа;
- T3 – рак достиг серозной (наружной) оболочки желудка, но не пророс в нее;
- T4 – опухоль проросла в серозную оболочку (T4a), в соседние структуры (T4b).
Классификация в зависимости от наличия поражения в регионарных лимфатических узлах:
- Nx – невозможно оценить метастазы в лимфатических узлах;
- N0 – метастазы в регионарных лимфоузлах не обнаружены;
- N1 – поражены 1-2 лимфоузла;
- N2 – опухолевые клетки распространились в 3-6 лимфоузлов;
- N3 – метастазы в 7-15 (N3a) или в 16 и более (N3b) лимфоузлах.
Классификация в зависимости от наличия отдаленных метастазов:
- M0 – отдаленные метастазы не обнаружены;
- M1 – обнаружены отдаленные метастазы.
Аденокарциному делят на 4 стадии:
- I стадия (T1M0N0 – стадия Ia; T1N1M0, T2N0M0 – стадия Ib). Опухоль находится в пределах слизистой оболочки и подслизистой основы, не прорастает вглубь стенки желудка. Иногда раковые клетки обнаруживают в близлежащих лимфатических узлах.
- II стадия (T1N2M0, T2N1M0, T3N0M0 – стадия IIa; T1N3aM0, T2N2M0, T3N1M0, T4aN0M0 – стадия IIb). Опухоль прорастает в мышечный слой стенки желудка и распространяется в лимфатические узлы.
- III стадия (T2N3aN0, T3N2M0, T4aN1M0, T4aN2M0 – стадия IIIa; T1N3bM0, T2N3bM0, T3N3aM0, T4aN3aM0, T4bN1M0 – стадия IIIb; T3N3bM0, T4aN3bM0, T4bN3aM0 – стадия IIIc). Рак пророс через всю стенку желудка и, возможно, распространился на соседние органы, успел сильнее поразить близлежащие лимфатические узлы.
- IV стадия (любые T и N, M1). Есть отдаленные метастазы.
Метастазы рака желудка
Раковые клетки могут отрываться от материнской опухоли и мигрировать в другие части тела различными путями:
- С током лимфы они могут попасть в лимфатические узлы брюшной полости, а из них — в лимфоузлы надключичной области — метастаз Вирхова. Метастаз в лимфоузлы, окружающие прямую кишку, называют метастазом Шницлера.
- С током крови раковые клетки чаще всего распространяются в печень, реже — в легкие.
- Также раковые клетки могут рассеиваться по брюшной полости. Если они оседают на яичниках, образуется метастаз Крукенберга, в пупке — метастаз сестры Марии Джозеф.Редко при раке желудка обнаруживают метастазы в головном мозге, костях.
Симптомы: как проявляется рак желудка?
На ранних стадиях рак желудка либо не имеет симптомов вообще, либо маскируется под другие заболевания: гастрит, обострение язвенной болезни. Ухудшение аппетита и боли под ложечкой редко заставляют людей сразу же подозревать онкозаболевание и бежать в больницу. Обычно ограничиваются диетой и приемом разрекламированных таблеток «от желудка». Если человек уже страдает язвенной болезнью, он может воспринять первые признаки рака желудка как очередное обострение язвы. И уже позже, когда диагностировано онкологическое заболевание, больной вспоминает, что проявления были «не такими, как всегда».
Существует так называемый «синдром малых признаков» — его сформулировал один из основоположников советской онкологии, Александр Иванович Савицкий. Если беспокоят похожие симптомы — это повод сходить к врачу и провериться:
- Необъяснимая слабость и повышенная утомляемость.
- Плохой аппетит.
- Снижение работоспособности.
- Потеря веса.
- «Желудочный дискомфорт»: неприятные ощущения, из-за которых даже любимая еда больше не радует.
В дальнейшем нарастают более яркие, «кричащие» признаки. Они зависят от того, в какой части органа находится опухоль:
- Дисфагия. Возникает, если новообразование сдавливает место перехода желудка в пищевод. Сначала становится сложно глотать твердую пищу, затем и жидкую.
- Рвота недавно съеденной пищей. Характерна для опухолей в нижней части желудка, в месте перехода в двенадцатиперстную кишку.
- Стойкая изжога.
- Постоянные боли в области желудка, которые отдают в спину. Они не проходят ни днем, ни ночью.
- Потеря веса.
- Увеличение живота. Возникает из-за асцита — скопления жидкости в брюшной полости.
- Под ложечкой можно почувствовать и нащупать жесткое выпирающее образование. Это — опухоль, которая срослась с передней брюшной стенкой.
Со временем в опухоли начинаются процессы изъязвления и распада, развивается желудочное кровотечение. Проявляется оно в виде черного дегтеобразного стула, рвоты, которая выглядит как «кофейная гуща» или содержит примеси алой крови. Если человек теряет много крови, он становится бледным, возникает слабость, головокружение. У некоторых людей рак диагностируется, когда их приводят в клинику в таком состоянии на машине «Скорой помощи».
Как вовремя диагностировать заболевание? Что такое скрининг, и почему он важен?
Статистика говорит о том, что в 75% случаев рак желудка диагностируют уже на распространенной стадии, когда опухоль успевает прорасти в соседние ткани, дать метастазы. Лечить таких больных сложно, прогноз, как правило, неблагоприятный. Обычно выраженные симптомы говорят о том, что рак уже успел распространиться по организму.
Как проверить желудок на рак: на ранних стадиях помогает скрининг — регулярные обследования людей, которые не испытывают никаких симптомов. В качестве скринингового исследования применяют гастроскопию — эндоскопическое исследование, во время которого в желудок вводят гибкую трубку с миниатюрной видеокамерой и лампочкой на конце. Насколько эффективна гастроскопия? Лучше всего это демонстрирует японский опыт. Распространенность рака желудка в Японии очень высока, а смертность от него одна из самых низких в мире. Достичь этого удалось благодаря внедрению массового скрининга.
В Европейской онкологической клинике существуют специальные скрининговые программы, которые помогают вовремя диагностировать разные онкологические заболевания. Посетите врача, узнайте о своих рисках и получите индивидуальные рекомендации по поводу скрининга.
Какие методы диагностики может назначить врач?
Помимо гастроскопии, программа диагностики рака желудка может включать:
- Рентгенографию, перед которой пациенту дают выпить контрастный раствор. При этом контуры желудка хорошо видны на снимках.
- Компьютерную томографию, позитронно-эмиссионную томографию.
- Диагностическую лапароскопию. Это операция, во время которой в живот пациента через отверстия вводят лапароскоп с миниатюрной видеокамерой и специальные инструменты. Процедура помогает оценить, как далеко за пределы желудка успел распространиться процесс.
- Биопсию. Врач получает образец подозрительной ткани и отправляет в лабораторию для изучения под микроскопом. Этот метод диагностики помогает максимально точно диагностировать онкологическое заболевание и установить тип рака. Биопсию можно провести во время гастроскопии, хирургического вмешательства.
Современные принципы лечения рака желудка
Основной метод лечения рака желудка — хирургический. Объем операции зависит от того, на какой стадии обнаружена опухоль. Если она не успела распространиться вглубь стенки органа, проводят эндоскопическую резекцию — удаление пораженного участка при помощи инструмента, введенного через рот, как во время гастроскопии.
При субтотальной гастрэктомии удаляют часть органа, пораженную опухолевым процессом. На более поздних стадиях орган приходится удалять целиком вместе с окружающими тканями. При этом пищевод соединяют с тонкой кишкой. Если лимфатические узлы в брюшной полости поражены метастазами, их также нужно удалить.
В запущенных случаях, когда излечение невозможно, проводят паллиативную операцию. Хирург удаляет пораженную часть желудка, чтобы облегчить состояние пациента.
Лучевая терапия при раке желудка бывает:
- неоадъювантной — проводится перед операцией, чтобы уменьшить размеры опухоли и облегчить её удаление;
- адъювантной — чтобы уничтожить раковые клетки, которые остались в организме после операции.
Наиболее распространенные побочные эффекты лучевой терапии при облучении области живота: тошнота, нарушение пищеварения, диарея.
Химиотерапия также бывает адъювантной и неоадъювантной. Часто её сочетают с лучевой терапией. Химиолучевая терапия может стать основным методом лечения при метастатическом раке на поздних стадиях, когда прогноз неблагоприятный, но есть возможность облегчить симптомы и продлить жизнь больного.
В некоторых случаях эффективны таргетные препараты: трастузумаб, рамуцирумаб, иматиниб, сунитиниб, регорафениб. Но они подходят лишь в тех случаях, когда опухолевые клетки обладают определенными молекулярно-генетическими свойствами.
Какой прогноз при раке желудка?
Прогноз при раке желудка зависит от стадии опухоли, на которой был установлен диагноз и начато лечение. Шансы на стойкую ремиссию наиболее высоки, если опухоль не проросла за пределы слизистой оболочки и подслизистой основы. При метастазах прогноз, как правило, неблагоприятен.
В онкологии существует такой показатель, как пятилетняя выживаемость. Он показывает, какой процент больных остаются живы в течение 5-ти лет. Срок достаточно большой, в определенном смысле его можно приравнять к выздоровлению. Пятилетняя выживаемость при разных стадиях рака желудка составляет:
- I стадия — 57-71%;
- II стадия — 33-46%;
- III стадия — 9-20%;
- IV стадия — 4%.
Некоторые цифры и факты:
- Эксперты Всемирной организации здравоохранения (ВОЗ) утверждают, что ежегодно от рака желудка во всем мире погибают 754 000 людей.
- В XXI веке распространенность заболевания снижается, но в разных странах неодинаково. Так, на одного больного из Великобритании приходится двое из России и трое из Японии.
- По распространенности среди прочих онкозаболеваний рак желудка занимает пятое место, но среди причин смерти — третье.
- Одна из лидирующих стран по распространенности рака – Япония, во многом за счет характера питания.
В Европейской онкологической клинике применяются наиболее современные методы лечения рака желудка и других онкологических заболеваний. Даже если прогноз неблагоприятен, это не означает, что больному ничем нельзя помочь. Наши врачи знают, как облегчить симптомы, обеспечить приемлемое качество жизни, продлить жизнь
Цены на лечение рака желудка на 1-4 стадиях в Европейской онкологической клинике
- Консультация онколога — 5100 руб.
- Лечение рака желудка — от 60000 руб.
- Проведение внутриплевральной химиотерапии (инфузия, без стоимости лекарственных препаратов) — 21900 руб.
- Проведение иммунотерапии (без стоимости лекарственных препаратов) — 17200 руб.
Источник
