Цирамза при раке желудка

Цирамза (латинское наименование Cyramza) — это препарат последнего поколения, применяемый как в монотерапии, так и в комбинации с другими лекарственными средствами для лечения ряда онкологических заболеваний. На мировом фармацевтическом рынке медикамент появился сравнительно недавно. В 2014 году был одобрен к применению в США, а годом позже — и в европейских странах.
Препарат представляет собой производное человеческих моноклональных антител. Механизм действия тесно связан с блокированием специфических рецепторов фактора роста эндотелия сосудов.
Сокращенно этот белок обозначают как VEGF по первым буквам английского названия (vascular endothelial growth factor).
В ходе рандомизированных клинических испытаний была установлена безопасность и эффективность применения лекарства в сочетании с препаратами для химиотерапии, некоторыми цитостатиками (в частности, с Доцетакселом и Паклитакселом). Возможность безвредной для пациента лекарственной комбинации расширяет перечень показаний к приему средства. Цирамзу назначают для лечения метастатического немелкоклеточного рака легких, рака желудка или гастроэзофагиальной аденокарциномы. Средство также применяют для терапии распространенной колоректальной опухоли.
Но несмотря на высокую эффективность, Цирамза не является медикаментом первой линии терапии. Лекарство назначают при отсутствии результата и дальнейшем прогрессировании патологии на фоне других схем лечения.
Краткая информация о производителе
Производитель Cyramza — американская фармацевтическая компания Eli Lilly, основанная еще в конце 1980-х. Eli Lilly приобрела мировую известность как первая фирма, запустившая массовое производство инсулина. Названа корпорация по имени ее основателя — Илая Лилли, который открыл собственную фармацевтическую лабораторию. От других она отличалась производством удобных для применения лекарственных средств в желатиновых капсулах.
Изначально Eli Lilly занимались выпуском антибиотика (Цефалоспорина, Пенициллина и др.), но впоследствии компания начала более серьезные разработки. Одним из самых известных препаратов корпорации является антидепрессант Прозак. Кроме того, Eli Lilly специализируется на лекарственных средствах, применяемых для терапии онкологических заболеваний различного генеза.
Общие принципы лечения пациентов
Цирамза в комбинации с Доцетакселом назначают больным с метастатическим немелкоклеточным раком легких при условии прогрессирования заболевания на фоне или после окончания химиотерапии препаратами платины.
При метастатическом раке желудка или аденокарциноме применяется либо самостоятельно, либо в комбинации с Паклитакселом. Лекарство прописывают, если использование медикаментов, содержащих платину или фторпиримидин, не приносит должного результата.
При колоректальном раке Цирамзу назначают на фоне так называемой схемы FOLFIRI (применение препаратов Иринотекана, Лейковорина и 5-фторурацила). Однако использование подобного принципа лечения целесообразно только в том случае, если патология развивается несмотря на прием Бевацизумаба, Оксалиплатина и Фторпиримидина.
Подробное описание инструкции по применению лекарственного средства
Схема использования Цирамзы достаточно сложна, а побочные реакции часто зависят от дозировки и параллельно применяемых препаратов. Поэтому на протяжении терапии Cymraza пациент должен находиться под медицинским контролем и сообщать врачу о любых изменениях в самочувствии.
Форма выпуска
Выпускается в виде жидкого концентрата для приготовления растворов для внутривенных инфузий во флаконах объемом 10 мл и 50 мл.
Состав
Основное действующее вещество — соединение рамуцирумаб (латинское международное название ramucirumab) в дозировке 10 мг на 1 мл. Общее содержание активного компонента в готовом концентрате объемом 10 и 50 мл составляет 100 и 500 мг соответственно.
Фармакологическая группа
Цирамза относится к противоопухолевым средствам на основе моноклональных антител.
Фармакодинамика
Рамуцирумаб представляет собой комплекс моноклональных антител человека, который прерывает цепочку связывания факторов роста эндотелия сосудов со специфическими ферментами и белками. Таким образом лекарственное средство препятствует дальнейшему увеличению и прогрессированию опухоли, предупреждает формирование и распространение злокачественных метастазов.
Особенности распространения в организме
Фармакокинетика не зависит от основного диагноза. Как показывают данные клинических исследований, показатели одинаковы у пациентов с онкологическим поражением желудка, органов респираторного тракта и прямой кишки.
Препарат предназначен только для внутривенного введения, постепенно рамуцирумаб накапливается в организме, равновесная концентрация в крови достигается ориентировочно после шестой дозы. Механизмы биохимической трансформации действующего компонента Цирамзы неизвестен, но моноклональные антитела подвергаются распаду в процессе обмена веществ и выводятся одновременно с другими продуктами метаболизма.
При этом установлено, что показатели фармакокинетики рамуцирумаба не зависят от возраста пациента (в клинических исследованиях принимали участие больные от 19 до 85 лет), функциональной активности печени и почек. Также метаболизм и терапевтическая эффективность медикамента не зависит от массы тела, расовой и половой принадлежности.
Описание основного действующего вещества
Фактор роста эндотелия сосудов (VEGF)— сигнальный белок, которые отвечает за стимуляцию первичного формирования кровеносной системы в период эмбрионального развития, образования новых сосудов в уже зрелом возрасте. Кроме того, за счет VEGF регулирует проницаемость сосудистого эндотелия. Белковые фракции VEGF способствуют восстановлению кровотока в тканях, страдающих от ишемии и гипоксии.
Выделяют несколько разновидностей фактора роста эндотелия сосудов, отличающиеся по качественному и количественному составу протеиновых фракций — VEGF-А, VEGF-В, VEGF-С и т.д., плацентарный фактор PGF. Каждый из этих форм выполняет строго определенные функции. Например, VEGF-А отвечает за митоз клеток эндотелия, VEGF-С регулирует формирование сосудов лимфатической системы, VEGF-D определяет активность эндотелиальных структур бронхолегочной системы.
Но VEGF вырабатывается не только здоровыми тканями, но и опухолью. Таким образом новообразование формирует собственное сосудистое русло, снабжающее его питательными веществами. Активный кровоток способствует и быстрому распространению метастазов по организму.
Впервые идея ингибирования ангиогенеза возникла в начале 1970-х. Именно тогда медицинской общественности была представлена теория зависимости скорости роста опухоли от формирования новых сосудов и активности кровотока. Спустя несколько лет обнаружили первое вещество, относящееся к ингибиторам VEGF. Уже к 2000 году стадию клинических испытаний проходило больше 50 лекарственных веществ, и первый препарат на основе моноклональных антител (бевацизумаб) появился в 2003 году.
Но рамуцирумаб кардинально отличается от медикаментов первого поколения возможностью фармацевтической комбинации, меньшим риском возникновения нежелательных реакций, высоким профилем безопасности и хорошей переносимостью. Рамуцирумаб селективно блокирует активность факторов роста эндотелия сосудов типа А, С и D.
Показания к назначению
Цирамза назначается при следующих заболеваниях:
- злокачественные новообразования в тканях желудка;
- рак прямой кишки;
- локализованный или диссеминированный (метастатический) немелкоклеточный рак легких.
Врач также составляет схему комбинированной терапии и определяет продолжительность лечения.
Ограничения к использованию препарата
Абсолютными противопоказаниями к применению лекарства служат:
- индивидуальная непереносимость любого из ингредиентов;
- онкологическое поражение респираторного тракта с распространением злокачественного новообразования в полость магистральных сосудов;
- период вынашивания ребенка и грудного вскармливания;
- детский и подростковый возраст од 18 лет.
Особого врачебного внимания требуют больные с:
- гипертонией;
- склонностью к повышенной свертываемости крови и образованию тромбов;
- предрасположенностью к спонтанным кровотечениям;
- замедленной регенерацией тканей;
- крайне тяжелыми поражениями почек и печени.
Риск осложнений и нежелательных реакций повышается, если пациент соблюдает бессолевую диету.
Особенности применения и дозировки
Цирамза предназначена для внутривенных инфузий. Дозировку и кратность введения рассчитывают индивидуально. Эти параметры зависят от приема других лекарственных средств и диагноза. Процедура проводится только в условиях стационара под контролем квалифицированного медицинского персонала.
Перед приготовлением раствора концентрат проверяют на наличие посторонних включений, осадка и примесей. В качестве растворителя используют 0,9% раствор натрия хлорида. Общий объем препарата после разведения должен составлять 250 мл.
Схема лечения
Протокол терапии зависит от диагноза и сочетания с другими лекарствами.
| Период лечения | Дозировка и особенности применения |
| Метастатический немелкоклеточный рак легких | |
| День первый | Цирамза в дозировке 10 мг/кг, вводят в течение 60 минут Доцетаксел в количестве 75 мг/м2, вводится на протяжении 40 минут |
| День 2—21 | Перерыв |
| День 22 | Терапию начинают сначала |
| Онкология органов пищеварения (монотерапия) | |
| 1 раз в 2 недели | Цирамза в дозировке 8 мг/кг (время инфузии 60 минут) |
| Онкологические патологии желудка (комбинированная терапия) | |
| Дни 1, 8 и 15 (один цикл терапии составляет 28 дней) | Цирамза в количестве 8 мг/кг (время инфузии 60 минут) Паклитаксел в дозе 80 мг/м2 (длительность процедуры 60 минут) |
| Лечение колоноректального рака | |
| День первый (один цикл составляет 2 недели) | Цирамза в дозе 8 мг/кг (инфузию проводят в течение 60 минут) Иринотекан в дозировке 160 мг/м2 (90 минут) Лейковорин (фолиновая кислота) в количестве 0,4 г/м2 (2 часа) 5-фторурацил в дозе 2,4 г/м2 (46 — 48 часов) |
Подготовку к инфузии проводят при помощи антигистаминных препаратов (в тяжелых случаях вводят Дексаметазон).
Возможные побочные реакции во время лечения

Многие нежелательные эффекты на фоне терапии обусловлены действием других лекарственных средств (Доцетакселом, Паклитакселом и медикаментами для химиотерапии). Наиболее серьезными и опасными осложнениями являются:
- желудочно-кишечные кровотечения;
- тромбоэмболии.
При комбинации с Доцетакселом возможны:
- изменение показателей формулы крови;
- поражение слизистых оболочек ротовой полости;
- отечность;
- повышенная утомляемость;
- гипертензия;
- спонтанные кровотечения из носа.
При сочетании с Паклитакселом отмечают:
- снижение уровня нейтрофилов, тромбоцитов и лейкоцитов;
- расстройства белкового обмена;
- гипертонические нарушения;
- расстройства стула;
- частые эпизоды носовых кровотечений;
- поражение рото- и носоглотки, пищеварительного тракта;
- нарушения работы почек;
- общий упадок сил.
Схожие побочные реакции отмечают и при сочетании Цирамзы с комплексом химиотерапии FOLFIRI. Однако к перечисленным симптомам добавляется кожная сыпь и зуд.
Возможность сочетания с другими лекарственными средствами
Данных о безопасности комбинирования с препаратами (за исключением медикаментов, предназначенных для комплексной терапии) нет. Однако перед приемом каких-либо лекарств следует проконсультироваться с врачом.
Совместимость с алкоголем
Потреблять спиртное в период лечения не рекомендуют из-за повышения риска токсического влияния на печень и других осложнений.
Особые указания
По данным клинических исследований, Cyramza может вызвать необратимые патологии развития плода и течения беременности. Поэтому женщин детородного возраста предупреждают о необходимости соблюдения мер контрацепции. При этом с учетом риска побочных эффектов предпочтение лучше отдавать барьерным методам предохранения от возможного зачатия. Осторожность следует соблюдать не только на протяжении курса терапии, но в течение 3 месяцев после его окончания.

При лечении Цирамзой необходимо обращать внимание на следующие аспекты:
- Следует вести дневник с фиксацией показателей артериального давления. При превышении физиологических показателей и увеличения риска инфаркта и инсульта принимают решение об остановке лечения.
- Терапию останавливают при подозрении на прободение стенки кишечника.
- Особого контроля требуют пациенты с нарушением свертывания крови.
- На фоне первой или второй процедуры введения возможны осложнения в виде судорог, болей в области груди, спины, озноба, одышки, покраснения кожи, затрудненного дыхания, аритмии, гипертонии. В таком случае скорость введения лекарства замедляют вдвое. Если самочувствие не улучшается — применение препарата прекращают.
- При появлении симптомов стоматита назначают соответствующие лекарственные средства.
- При гипертонии проводят симптоматическую терапию. При необходимости процедуры введения приостанавливают.
На протяжении всего курса терапии сдают клинический анализ крови с обязательной коагулограммой. Также проводят исследование мочи для исключения протеинурии. Цирамза замедляет регенерацию тканей, что учитывают при планировании хирургического вмешательства. Рекомендуют остановить лечение как минимум за месяц до предполагаемой операции.
Симптомы передозировки
Данные отсутствуют.
Условия хранения
Концентрат для инфузий хранят в оригинальной упаковке в холодильнике при температуре от 2 до 8°С. Готовый раствор можно держать в холоде не больше суток, а при комнатной температуре — до 4 часов.
Срок годности
Два года в оригинальной упаковке (при соблюдении условий хранения).
Прекращение лечения
Решение об остановке терапевтического курса принимает врач.
Возможные аналоги
На сегодняшний день аналогов Цирамзы с таким же составом нет. Поэтому чтобы получить эффективное лечение, пациентам необходимо использовать только рамуцирумаб.
Стоимость препарата и где купить
В России Цирамза официально не зарегистрирована, поэтому в аптеках его в продаже нет. Единственный вариант провести курс прописанной терапии — купить препарат под заказ в Европе. Однако за рубежом средство также продают по рецепту, к тому же перевозка осложняется строгими требованиями к температурному режиму. Поэтому проще оформить доставку из Германии, воспользовавшись услугами посредников. Фирма привезет медикамент в Санкт-Петербург или в Москву.
Также подобные организации предоставляют услуги курьерской доставки по территории России. Транспортировка медикамента осуществляется со строгим соблюдением температурного режима. Цена лекарства зависит от дозировки и составляет примерно 500 евро за флакон 100 мг и 2190 евро за флакон объемом 500 мг.

Отзывы докторов
Виктория Андреевна Коренцова, онколог. Я достаточно часто веду пациентов с немелкоклеточным раком легких. Заболевание отличается устойчивостью к терапии и быстрому прогрессированию. Больным, плохо отвечающим на основные схемы лечения, рекомендую Цирамзу. Лекарство пока не продается в России, поэтому препарат заказывают напрямую из стран Европы. Курс переносится очень хорошо, побочные эффекты легко купируются.
Отзывы пациентов
Виктор, 38 лет. Жена борется с раком легких уже несколько лет. Я готов отдать что угодно, чтобы ей помочь. Постоянно отслеживаю свежие публикации. Когда появилась Цирамза, сразу попросил доктора составить новую схему лечения. Сам препарат заказал из Германии. Начали терапию почти сразу. Конечно, были осложнения, но незначительные. А результат уже есть.
Как отличить подделку
При доставке из Германии риск приобретения фальсификата сведен практически к нулю. Тем не менее, необходимо проверить чеки и уточнить температурный режим доставки и хранения медикамента на складе.
Результаты клинических исследований
Результаты многочисленных клинических испытаний убедительно доказывают эффективность и высокий профиль безопасности Цирамзы. Было отмечено увеличение общей выживаемости пациентов, остановку прогрессирования опухолевого процесса. В настоящее время исследования продолжаются в целях подбора оптимальной лекарственной комбинации и расширения списка показаний.
Условия отпуска из аптек
Официально купить лекарство в Москве нельзя из-за отсутствия регистрации. Самостоятельно приобрести Цирамзу в Европе можно с международным рецептом на латинском языке. Средство также можно заказать через посредников из Германии с доставкой в Россию.
Источник
Цель исследования – изучить эффективность и безопасность рамуцирумаба и паклитаксела у больных неоперабельным распространенным раком желудка во второй линии терапии.
Материал и методы. Пациенты получали рамуцирумаб 8 мг/кг внутривенно один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1-й, 8-й и 15-й дни 28-дневного цикла. Терапия в данном режиме продолжалась до прогрессирования заболевания или развития неприемлемой токсичности.
Результаты. Согласно окончательным результатам исследования, объективный ответ на терапию в виде частичной регрессии достигнут у семи пациентов, еще у 12 отмечалась стабилизация. Медиана выживаемости без прогрессирования составила 9,5 месяца. В настоящее время у четырех пациентов сохраняется контроль над заболеванием, они продолжают получать терапию. Медиана общей выживаемости достигла 12,5 месяца. Восемь пациентов живы, они перешагнули 24-месячный рубеж. Спектр нежелательных явлений незначительный. В большинстве случаев имела место гематологическая и негематологическая токсичность 1–2-й степени, серьезных нежелательных явлений не зафиксировано.
Заключение. Комбинация рамуцирумаба и паклитаксела характеризуется высокой эффективностью, приемлемым профилем токсичности и потенциально ассоциируется с высокой общей выживаемостью у пациентов с метастатическим раком желудка, прогрессирующим на фоне первой линии терапии.

Таблица 1. Исходные характеристики пациентов и опухолей

Рис. 1. Гистологические препараты опухоли желудка у пациента (А – до лечения рамуцирумабом и паклитакселом, 20-кратное увеличение, Б – до лечения, 40-кратное увеличение, В – после 20 недель лечения)
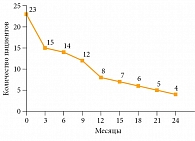
Рис. 2. Выживаемость без прогрессирования
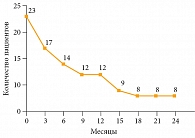
Рис. 3. Общая выживаемость
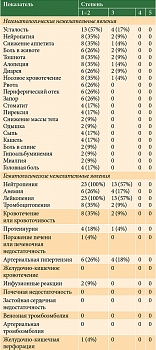
Таблица 2. Оценка токсичности
Введение
Рак желудка занимает четвертое место в структуре заболеваемости среди злокачественных новообразований у мужчин (7,8%) и шестое – у женщин (4,8%), но в структуре смертности прочно удерживает вторую позицию (10,3%). У большинства пациентов (69,6%) на момент постановки диагноза обнаруживается поздняя стадия заболевания (III или IV), когда возможности лечения существенно ограничены. У 45% больных с локальной формой рака желудка, выявленной при первичной диагностике, в течение пяти лет диагностируются метастазы. У 85% пациентов регионарная форма прогрессирует и переходит в метастатическую [1, 2].
В отсутствие противоопухолевого лечения продолжительность жизни больных диссеминированным раком желудка колеблется от трех до пяти месяцев.
Целесообразность и эффективность лекарственной терапии при диссеминированном раке желудка, подтвержденные в рандомизированных исследованиях II–III фаз, сегодня не вызывают сомнения. По сравнению с оптимальным симптоматическим лечением химиотерапия достоверно увеличивает продолжительность жизни больных.
Перечень противоопухолевых препаратов, эффективных при раке желудка, включает фторпиримидины для перорального и парентерального использования, производные платины, таксаны, антрациклины, ингибиторы топоизомеразы I, а также препараты таргетной терапии. Эффективность каждого препарата в монорежиме не превышает 30%. Увеличение эффективности лекарственной терапии связано с использованием комбинированных, достаточно токсичных режимов (DCXF, TOFL, FOLFORINOX и др.). Химиотерапия первой линии диссеминированного рака желудка носит паллиативный характер. Эффект отмечается у 35–40% больных с медианой общей выживаемости от восьми до десяти месяцев [3].
К настоящему моменту накоплены данные о молекулярно-генетических изменениях при раке желудка (экспрессия PDGF-альфа, HER2, TGF-бета, EGFR, c-met и др.), что позволяет рассчитывать на эффективность таргетной терапии.
HER2 – рецептор EGF гиперэкспрессирован у 13–22% больных раком желудка, чаще при кишечном типе рака. При НER2-позитивном раке желудка общая эффективность химиотерапии увеличивается на 12% при добавлении трастузумаба, а медиана выживаемости – до 13,8 месяца (в контрольной группе – 11,3 месяца). Иная ситуация при раке желудка с HER2-негативным статусом (78–87%). Например, в исследовании AVAGAST добавление бевацизумаба к химиотерапии способствовало увеличению частоты объективного ответа и медианы выживаемости без прогрессирования (ВБП), но не влияло на медиану общей выживаемости.
Сегодня не существует зарегистрированных режимов второй линии. Актуальной остается проблема разработки новых таргетных системных препаратов для повышения эффективности лечения на поздних стадиях заболевания [4].
Пациентам со статусом 0–2 по шкале ECOG (Eastern Cooperative Oncology Group – Восточная объединенная группа онкологов), не отягощенным тяжелыми сопутствующими заболеваниями, рекомендована химиотерапия второй линии. Сравнение таксанов и иринотекана во второй линии химиотерапии показало их сопоставимую эффективность.
Рамуцирумаб – первый биологический препарат, который применяли в режиме монотерапии. В исследовании REGARD на фоне использования рамуцирумаба увеличивалась медиана выживаемости у пациентов с поздними стадиями аденокарциномы желудка и прогрессированием заболевания после первой линии химиотерапии [5]. Комбинация рамуцирумаба с паклитакселом, статистически значимо увеличивающая общую выживаемость по сравнению с режимом плацебо в комбинации с паклитакселом (исследование RAINBOW), может быть использована в качестве нового стандартного режима второй линии лечения при раке желудка поздних стадий [6].
Материал и методы
Набор пациентов в исследование, проведенное на базе Областного онкологического диспансера г. Иркутска, осуществлялся с 1 июня 2016 г. до 31 октября 2017 г. в рамках Всероссийской программы безвозмездной передачи препарата рамуцирумаб для оказания помощи больным раком желудка поздних стадий с прогрессированием заболевания на фоне или после предшествующей химиотерапии на основе производных платины и/или фторпиримидинов по жизненным показаниям.
Главными критериями включения в исследование стали возраст старше 18 лет, гистологически подтвержденный метастатический рак желудка, прогрессирование заболевания после первой линии химиотерапии, состояние на момент исследования по ECOG 0–1, лабораторные показатели без клинически значимых отклонений от нормы. В исследование не включались пациенты с плоскоклеточным раком желудка, циррозом печени, желудочно-кишечной перфорацией, свищами, артериальной тромбоэмболией в течение последних шести месяцев, любым значительным желудочно-кишечным кровотечением, значительной венозной тромбоэмболией на протяжении последних трех месяцев перед рандомизацией, плохо контролируемой артериальной гипертензией, метастатическим поражением центральной нервной системы.
Все участники исследования подписали информированное согласие. Индивидуальные планы лечения были подготовлены на общем мультидисциплинарном консилиуме диспансера и одобрены Министерством здравоохранения Российской Федерации.
Больные получали лечение по следующей схеме: рамуцирумаб 8 мг/кг в виде внутривенной инфузии в течение 60 минут один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1-й, 8-й и 15-й дни 28-дневного цикла. Лечение проводилось на фоне профилактической противорвотной и десенсибилизирующей терапии, инфузионной поддержки. Каждые две недели исследователи оценивали эффективность по результатам компьютерной томографии грудной клетки, брюшной полости и малого таза, эзофагогастродуоденоскопии с биопсией, а также по определению лечебного патоморфоза. Лечение продолжалось до прогрессирования заболевания или развития неприемлемой токсичности.
Объективный ответ оценивали на основании данных мультиспиральной компьютерной томографии с внутривенным контрастированием по критериям RECIST v.1.1 и данных эзофагогастроскопии с биопсией (фото в формате DICOM, определение лечебного патоморфоза в биопсийном материале). При анализе токсичности использовали критерии СТС AE v. 4. Определялись ВБП (время от регистрации до документального подтверждения прогрессирования) и общая выживаемость (время от регистрации до даты смерти от любой причины). Функцию выживаемости описывали методом Каплана – Майера.
Результаты
В исследование с 1 июня 2016 г. по 31 октября 2017 г. было включено 23 пациента в возрасте от 21 до 69 лет (средний возраст – 45 лет), из них 11 (48%) женщин и 12 (52%) мужчин. Проспективный анализ промежуточных результатов применения рамуцирумаба и паклитаксела у больных неоперабельным распространенным раком желудка во второй линии терапии подтвердил эффективность и безопасность данной лечебной опции в наблюдаемой популяции. Четыре пациента прекратили лечение из-за ухудшения общего состояния. На первом контрольном обследовании по критериям RECIST констатировано прогрессирование заболевания. Пациенты умерли спустя 1–3 недели после обследования. У 19 больных на контрольном обследовании после двух месяцев терапии зафиксирована стабилизация заболевания. Они продолжили лечение.
У всех пациентов при гистологическом исследовании выявлена аденокарцинома (G1 – 9%, G2 – 39%, G3 – 52%). Измеряемые очаги по критериям RECIST v.1.1 зарегистрированы у 12 (52%) больных. У 11 (48%) пациентов выявлены только неизмеряемые очаги. Время до прогрессирования заболевания на фоне первой линии терапии у 17 (74%) пациентов составило менее шести месяцев, у шести (26%) – более полугода. Наличие мутации HER2/neu имело место у одного пациента. Общее состояние всех больных (100%) расценивалось как удовлетворительное – ECOG 0–1. У 20 (87%) пациентов число органов метастазирования не превышало двух. У большинства пациентов (74%) диагностированы перитонеальные метастазы. Асцит выявлен в десяти (43%) случаях. В анамнезе гастрэктомию перенесли десять (43%) больных, 13 (57%) пациентов не были оперированы (табл. 1).
Пациенты получили от трех до 54 введений рамуцирумаба и от пяти до 81 введения паклитаксела (6–108 недель лечения, в среднем 57 недель). Пять введений рамуцирумаба с последующим контрольным обследованием получили все участники исследования. Четыре (17%) пациента продолжают получать терапию в прежнем объеме без коррекции доз препаратов с соблюдением режима введения. Результаты компьютерной томографии и эзофагогастродуоденоскопии показали в четырех случаях прогрессирование опухоли после 3–5 введений рамуцирумаба (6–10 недель терапии). 19 пациентов продолжили терапию рамуцирумабом 8 мг/кг в виде внутривенной инфузии в течение 60 минут один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1-й, 8-й и 15-й дни 28-дневного цикла.
По данным мультиспиральной компьютерной томографии в соответствии с критериями RECIST v.1.1 и эзофагогастродуоденоскопии, объективный ответ на терапию получен у 19 пациентов. Частичная регрессия достигнута у семи (30%) больных, еще у 12 (52%) – стабилизация. У четырех (18%) пациентов при первом контрольном обследовании после 6–10 недель терапии зарегистрировано прогрессирование заболевания. ВБП у четырех (18%) больных составила 24 месяца. Случаев полной регрессии опухоли не зафиксировано. Частичная регрессия опухоли заключалась в выраженном улучшении эндоскопической картины первичной опухоли по результатам эзофагогастродуоденоскопии и определению патоморфоза опухоли 4-й степени в биопсийном материале (рис. 1). Динамика в отношении перитонеальных метастазов отсутствовала.
Медиана ВБП составила 9,5 месяца. Шестимесячная ВБП зарегистрирована у 14 (61%) пациентов, 12-месячная – у восьми (35%) (рис. 2). Медиана общей выживаемости составила 12,5 месяца. Общая выживаемость у 14 (61%) пациентов достигла шести месяцев, у 12 (52%) – 12 месяцев (рис. 3). На данный момент четыре (18%) пациента продолжают получать терапию, сохраняя контроль над опухолью. Продолжительность терапии превысила 24 месяца.
Четыре пациента умерли в течение 12 недель от начала терапии вследствие прогрессирования основного заболевания. Случаев гематологической и негематологической токсичности, приведших к отмене терапии, не отмечалось. Чаще имела место гематологическая токсичность. Нейтропения 1–2-й степени, обусловленная применением паклитаксела, зафиксирована у 23 (100%) пациентов. У шести (26%) больных наблюдалось развитие артериальной гипертензии, у восьми (35%) возникли носовые кровотечения, у четырех (18%) – протеинурия. Полный спектр токсичности представлен в табл. 2.
Обсуждение
Показатели ВБП и общей выживаемости значительно превысили показатели, которые обычно имеют место при проведении второй линии стандартной терапии метастатического рака желудка. Несмотря на использование разных комбинаций, объективные ответы не превысили 20–25%, а медиана продолжительности жизни – пяти-шести месяцев (от начала второй линии химиотерапии) [7]. Аналогичные результаты получены при использовании паклитаксела в монорежиме или в комбинациях с другими препаратами [8–13]. Еженедельное применение паклитаксела (60–80 мг/м2) характеризовалось меньшей токсичностью (нейтропения 3–4-й степени в 16–32% случаев) при одинаковом количестве объективных ответов (8–27%) по сравнению со стандартным трехнедельным режимом в серии японских исследований [9, 10]. На фоне применения паклитаксела в комбинациях с цисплатином отмечалась высокая частота нейтропении 3–4-й степени (до 34%) и периферической нейропатии 2–3-й степени (до 38%) [12, 13]. По сравнению с терапией других нозологий терапия рака желудка несколько отставала в плане внедрения в клиническую практику таргетных препаратов. Тем не менее сегодня рак желудка является одним из «полигонов», на которых испытывают новые варианты персонализированного лечения. В последнее время появляется все больше обнадеживающих результатов лечения этой агрессивной и рефрактерной к стандартной химиотерапии опухоли [14]. Отрицательные результаты исследования с использованием бевацизумаба не перечеркнули дальнейший интерес к изучению антиангиогенной терапии при раке желудка. Следующим препаратом этой серии стал рамуцирумаб – антагонист фактора роста эндотелия сосудов, связывающий рецептор VEGFR-2 и блокирующий лиганды рецептора VEGF-A, VEGF-C и VEGF-D. По сравнению с плацебо на фоне монотерапии рамуцирумабом статистически значимо улучшались показатели общей выживаемости (исследование REGARD). Рамуцирумаб статистически значимо увеличивал общую выживаемость у пациентов с аденокарциномой желудка или желудочно-пищеводного соединения поздних стадий и прогрессированием заболевания после первой линии химиотерапии. При использовании препарата в два раза снижался риск прогрессирования заболевания, а также риск смерти от любой причины. Преимущество рамуцирумаба по показателю выживаемости сохранялось практически во всех подгруппах пациентов. Влияние на показатели общей выживаемости было несколько ниже у женщин, однако расчетные значения ВБП у них были в пользу рамуцирумаба. После анализа влияния потенциальных расхождений в исходных характеристиках между лечебными группами преимущество рамуцирумаба в отношении общей выживаемости и ВБП после корректировки по другим прогностическим факторам оставалось без изменения. В данной популяции пациентов переносимость рамуцирумаба была хорошей. При этом частота большинства нежелательных явлений была одинаковой в группах рамуцирумаба и плацебо. Гипертензия – нежелательное явление, ассоциируемое с большинством антиангиогенных препаратов, чаще отмечалось в группе рамуцирумаба. Гипертензия 3-й степени наблюдалась у единичных пациентов, получавших рамуцирумаб. Данные о качестве жизни, согласно оценке пациентов, были скудными. Тем не менее эффект рамуцирумаба не уступал таковому плацебо. Более того, время до ухудшения оценки общего состояния было статистически значимо более продолжительным у пациентов, получавших рамуцирумаб [5]. Впоследствии положительными оказались результаты исследования фазы III по добавлению рамуцирумаба к паклитакселу во второй линии терапии рака желудка. Все это послужило основанием для регистрации в 2014 г. препарата для лечения больных метастатическим раком желудка [4, 15].
Рамуцирумаб в комбинации с еженедельным паклитакселом в отличие от других таргетных препаратов с антиангиогенным действием достоверно увеличивал частоту объективных ответов. В клиническом исследовании RAINBOW III фазы эффективность и безопасность рамуцирумаба и паклитаксела сравнивали с таковыми паклитаксела и плацебо. Добавление к терапии паклитакселом рамуцирумаба позволило добиться увеличения показателя средней выживаемости до 9,6 месяца. У пациентов, принимавших паклитаксел и плацебо, средняя выживаемость составила 7,4 месяца. Кроме того, на фоне терапии рамуцирумабом и паклитакселом снизился риск прогрессирования заболевания или смерти на 37% по сравнению с использованием паклитаксела и плацебо, ВБП увеличилась на 52% [6]. В настоящее время планируется исследование фазы III RAINFALL по применению рамуцирумаба в первой линии терапии рака желудка.
При выборе и проведении второй линии терапии метаст?
