Химиотерапия при раке желудка 4 стадии с карциноматозом
Стадию рака желудка определяют по трем показателям, которые обозначаются буквами латинского алфавита:
- T (tumor) — размер первичной опухоли, глубина ее прорастания в стенку желудка и распространение на соседние ткани.
- N (nodes) — распространение раковых клеток в ближайшие (регионарные) лимфатические узлы.
- M (metastasis) — наличие метастазов, вторичных очагов, которые возникли в результате распространения раковых клеток с током крови или лимфы из желудка в другие органы.
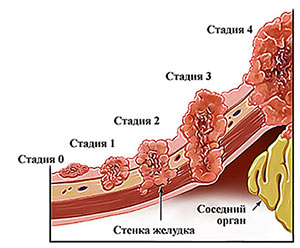
При раке желудка 4 стадии первичная опухоль может иметь любые размеры, прорастать в стенку желудка на любую глубину, распространяться или не распространяться в соседние органы, лимфатические узлы. Но всегда есть отдаленные метастазы. Это ключевой признак.
В какие органы чаще всего метастазирует рак желудка?
Опухолевые клетки могут распространяться из желудка в другие органы разными способами:
- Рак может непосредственно прорастать в соседние органы. Чаще всего — в поджелудочную железу, реже — в поперечную ободочную кишку, левую долю печени.
- Иногда раковые клетки распространяются по поверхности брюшины — тонкой пленки из соединительной ткани, которая выстилает изнутри стенки брюшной полости и покрывает внутренние органы. При этом у женщин нередко обнаруживаются метастазы в яичниках (опухоль Крукенберга).
- Гематогенным путем (с током крови) рак желудка 4 стадии чаще всего распространяется в печень, реже — в легкие и кости.
- Лимфогенное распространение раковых клеток происходит вдоль печеночно-дуоденальной связки, чревного ствола, сосудов селезенки.
При раке желудка могут возникать специфические метастазы. Для них существуют специальные названия:
- Метастаз Вирхова — в лимфатическом узле, расположенном над ключицей.
- Метастаз сестры Марии Джозеф — в пупок.
- Метастазы Шницлера — в лимфатические узлы, расположенные вокруг прямой кишки.
- Метастазы Айриша — в лимфатические узлы, расположенные в подмышечной области.
Согласно статистике, рак желудка 4 стадии чаще всего метастазирует в печень (у 48% пациентов), брюшину (32%), легкие (15%), кости (12%).
Симптомы
При раке желудка 4 стадии могут беспокоить такие неспецифические симптомы, как плохой аппетит и потеря веса, вплоть до сильного истощения (кахексии), дискомфорт, чувство тяжести, распирания и боль в животе, изжога, тошнота и рвота (иногда с кровью), запоры, примесь крови в стуле.
Специфические симптомы — это желудочное кровотечение при распаде опухоли и анемия из-за кровопотери. Поражение опухолевыми клетками брюшины приводит к асциту (скоплению жидкости в брюшной полости). Также характерны зловонный стул черного цвета и рвота массами, напоминающими кофейную гущу.
Рак желудка длительно не дает о себе знать. На ранних стадиях многие люди не испытывают симптомов и не знают, что больны. У четырех из пяти больных диагноз устанавливают, когда опухоль уже успевает распространиться на другие органы.

Люди, имеющие повышенный риск рака желудка, должны регулярно проходить скрининг — гастроскопию. Это помогает диагностировать опухоль на ранних стадиях.
Методы диагностики
При раке желудка 4 стадии применяют разные методы диагностики, они помогают выявить первичную опухоль и вторичные очаги в других органах:
- Эндоскопическое исследование (гастроскопия, ФГДС) помогает обнаружить патологические изменения на слизистой оболочке желудка.
- Эндоскопическое ультразвуковое исследование — по сути та же ФГДС, но на конце гастроскопа находится ультразвуковой датчик. Он может «просветить» соседние органы и лимфатические узлы через стенку желудка. Зачастую это намного информативнее, чем обычное УЗИ.
- Биопсия. Исследование, во время которого врач получает образец опухолевой ткани и отправляет на анализ в лабораторию. На данный момент биопсию можно назвать самым точным методом диагностики онкозаболеваний. Исследовать можно ткань желудка, лимфатических узлов, других органов.
- Рентгенография с контрастным усилением. Этот метод диагностики используется довольно редко, так как гастроскопия более информативна (к тому же, во время нее можно взять материал для биопсии). Но рентгенография — менее инвазивный метод, во время нее в желудок не вводят никаких инструментов. Иногда это преимущество важно. Суть метода в том, что пациенту дают выпить раствор непроницаемого для рентгеновских лучей сульфата бария, затем делают снимки.
- Компьютерная томография. Более «продвинутая» разновидность рентгенографии, позволяет получить послойные снимки-«срезы» всего тела, на которых будет видна опухоль желудка и очаги в других органах.
- МРТ — в каком-то смысле аналог компьютерной томографии, но во время этого исследования вместо рентгеновских лучей используют мощное магнитное поле. Это безопаснее. МРТ лучше «видит» мягкие ткани. Минус метода в том, что он более сложен, нужен дорогой аппарат, который есть далеко не во всех клиниках.
- Позитронно-эмиссионная томография (ПЭТ). Идеальна для поиска метастазов, которые не могут обнаружить другие методы диагностики. В организм вводят безопасный радиоактивный сахар. Он накапливается в раковых клетках, так как они активно потребляют энергию, и делает их видимыми на специальных снимках.
- Рентгенография грудной клетки. Применяется для поиска метастазов в легких.
Современные методы лечения
Лечение при раке желудка четвертой стадии преследует две цели:
- Сократить размеры опухоли, замедлить ее прогрессирование.
- Устранить симптомы: боль, анемию, нарушение проходимости желудка, асцит.
Хирургическое лечение
Хирургическое вмешательство при раке желудка, как правило, направлено на восстановление проходимости, если опухоль мешает движению пищи. Иногда удается выполнить субтотальную резекцию — удалить часть желудка. Чаще проводят шунтирование: создают сообщение между верхней частью желудка и тощей кишкой, в обход участка, перекрытого опухолью.
В случаях, когда операцию выполнить нельзя, можно провести стентирование желудка. В месте его соединения с пищеводом или двенадцатиперстной кишкой (в зависимости от локализации опухоли) с помощью эндоскопа устанавливают стент — полый каркас с металлической сетчатой стенкой. Иногда проводят эндоскопическую абляцию: через эндоскоп подают лазерный луч, который разрушает опухолевую ткань.
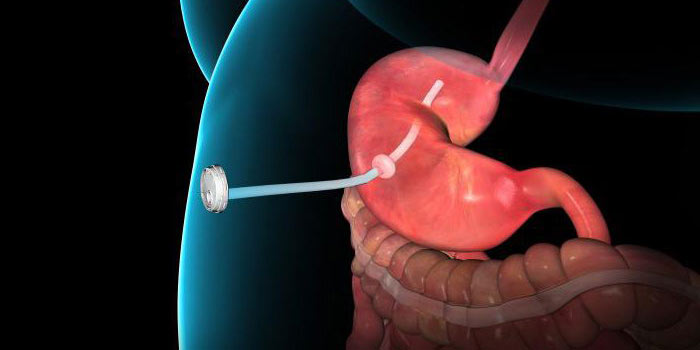
Если человек с раком желудка 4 стадии не может нормально есть, и хирургическое лечение не помогает это исправить, может быть наложена гастростома или еюностома. Желудок или тощую кишку подшивают к коже, формируют отверстие. Через него будет происходить питание.
Химиотерапия и лучевая терапия
При раке желудка с метастазами проводят паллиативную химиотерапию и лучевую терапию. Их главная задача — уменьшить размеры опухоли и продлить жизнь пациента. Применяют разные комбинации химиопрепаратов:
- Эпирубицин + цисплатин + 5-фторурацил.
- Доцетаксел + цисплатин + 5-фторурацил.
- Иринотекан + цисплатин.
- Иринотекан + 5-фторурацил.
- Иринотекан + капецитабин.
- Оксалиплатин + 5-фторурацил.
- Оксалиплатин + капецитабин.
Комбинации из трех препаратов, а также химиотерапия в сочетании с лучевой терапией (химиолучевая терапия) более эффективны, но хуже переносятся, несут более высокий риск побочных эффектов.
Таргетная терапия
Таргетные препараты могут быть эффективны в случаях, когда химиотерапия не помогает. Это современная группа противоопухолевых средств, они атакуют определенные молекулы-мишени, которые важны для роста опухолевой ткани. При раке желудка четвертой стадии применяют два таргетных препарата:
- Трастузумаб блокирует белок-рецептор HER2, который находится на поверхности раковых клеток и заставляет их размножаться. Активность этого белка повышена в каждой пятой злокачественной опухоли желудка (такой рак называют HER2-позитивным).
- Рамуцирумаб блокирует VEGF — белок, который вырабатывается раковыми клетками и стимулирует рост новых сосудов, снабжающих опухоль кислородом и питательными веществами.
Таргетные препараты применяют самостоятельно или в сочетании с химиопрепаратами. Они эффективны, когда раковые клетки обладают определенными молекулярно-генетическими особенностями, когда в них повышена активность соответствующего «вещества-мишени».
Иммунотерапия
Иммунитет человека устроен очень сложно. В нем есть множество звеньев и всевозможных механизмов регуляции. Например, для того чтобы сдерживать себя от атаки на собственные здоровые ткани, иммунная система использует особые вещества — контрольные точки. Иногда их используют злокачественные опухоли, чтобы защититься от иммунной атаки. С этим помогают бороться современные лекарства, которые относятся к классу иммунопрепаратов и называются ингибиторами контрольных точек.

При раке желудка 4 стадии иногда эффективен ингибитор контрольных точек под названием пембролизумаб (Кейтруда).
Лечение анемии
Кровотечение при раке желудка может привести к анемии — состоянию, при котором в крови снижается количество эритроцитов и гемоглобина. В результате ухудшается качество жизни, выживаемость. Приходится снижать дозы химиопрепаратов и сокращать продолжительность курсов химиотерапии, лечение становится менее эффективным.
С анемией при раке желудка 4 стадии борются с помощью препаратов железа, фолиевой кислоты, витамина B12, переливаний эритроцитарной массы. Существуют препараты-аналоги гормона эритропоэтина, который вырабатывается почками и активирует образование новых эритроцитов в красном костном мозге. Обеспечить организм дополнительным количеством железа помогают некоторые рекомендации относительно рациона питания.
Лечение асцита при раке желудка 4 стадии
Асцит — скопление жидкости в брюшной полости — одно из самых частых осложнений рака желудка четвертой стадии. Это состояние возникает по двум причинам:
- Из-за метастазов рака в брюшину. При этом увеличивается проницаемость стенок кровеносных сосудов, жидкость из них в большем количестве поступает в брюшную полость. Работа лимфатических сосудов нарушается, они не могут выводить жидкость.
- Из-за метастазов в лимфатических узлах. Нарушается отток лимфы, лимфатические сосуды, которые в норме должны выводить жидкость из брюшной полости, больше не могут выполнять свою функцию.
При асците проводят лапароцентез: в стенке брюшной полости делают прокол и выводят через него лишнюю жидкость. Для того чтобы обеспечить постепенное выведение жидкости в течение некоторого времени, применяют специальные перитонеальные порт-системы. Уничтожать метастазы в брюшине помогает внутрибрюшинная химиотерапия, когда химиопрепарат вводят в брюшную полость. При любом из видов лечения необходима специальная диета и приём ряда препаратов, уменьшающих тошноту.
Сколько живут с раком желудка 4 стадии?
Главный прогностический показатель при онкологических заболеваниях — пятилетняя выживаемость. Он обозначает процент пациентов, которые остались живы спустя 5 лет с момента диагностики и начала лечения злокачественной опухоли. Для IV стадии рака желудка этот показатель составляет 4%. В течение пяти лет 96 больных из 100 погибают, 4 остаются в живых. Но такая удручающая статистика — не повод сдаваться. Методы лечения совершенствуются, сегодня онкологи могут сделать намного больше, чем десятилетия назад. Пациенты, которым не помогают стандартные методы, могут принять участие в клинических испытаниях новых препаратов.
Источник
Канцероматоз брюшины — опухолевое поражение листков слизистой оболочки, покрывающей органы и внутреннюю стенку живота. Преимущественно обусловлен разрастанием метастазов рака в брюшной полости, иногда возможно развитие первичного злокачественного процесса — мезотелиомы в самой брюшине.
Метастатическое поражение правильнее называть «карциноматоз», поскольку карцинома — синоним рака. Аналогично метастазы саркомы в брюшину именуют «саркоматоз».
Частое, но не обязательное проявление перитонеального канцероматоза, — выработка асцитической жидкости. С асцитом или без, но поражение брюшины злокачественным процессом всегда угрожает жизни больного и требует очень непростого лечения.
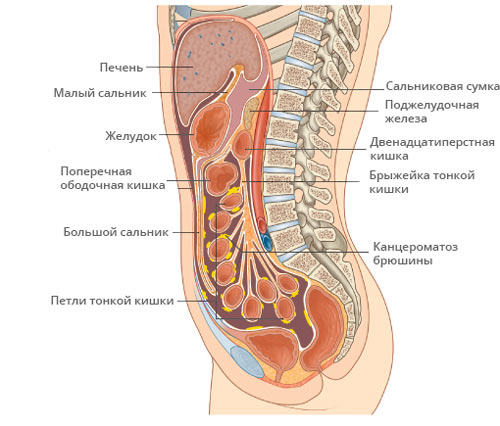
Причины канцероматоза брюшины
Не всякая оторвавшаяся от материнской раковой опухоли клетка способна стать метастазом, в кровеносном русле погибает львиная доля циркулирующих злокачественных клеток. Для обретения способности стать метастазом раковая клетка должна измениться внутренне — научиться вырабатывать вещества, позволяющие самостоятельно жить и внедриться в другом месте, подавляя нормальные клетки.
Оторвавшиеся от узла клетки мигрируют на большие расстояния, раздвигая нормальные клетки, имплантируются в брюшную слизистую, способны даже внедряться внутрь других клеток. После закрепления на местности, начинается размножение и образование целой клеточной колонии.
Кроме переноса метастатических клеток по крови и лимфе, распространение идёт и внутри полости живота — трансцеломически. Не совсем ясно почему злокачественные клетки задерживаются в брюшине, предполагается благотворное действие микроклимата. Большинство метастазов находят в местах с более спокойной обстановкой и слабой перистальтикой органов, или там, где активно всасывается внутрибрюшная жидкость.
Часто клетки «разбрасываются» во время операции и при лапароскопическом вмешательстве вероятность обсеменения вдвое ниже, чем при классической хирургии. Во время операции обязательно проводится профилактика раковой диссеминации путём неоднократной обработки специальными растворами, но самый эффективный способ очищения от диссеминатов — внутриполостная химиотерапия на фоне гипертермии (HIPEC).
При каких заболеваниях развивается
Перитонеальный канцероматоз диагностируют у каждого третьего пациента с новообразованием желудочно-кишечного тракта. Метастазы по брюшине характерны для карцином желудка и поджелудочной железы — поражается до 40% пациентов. При раке кишечника канцероматоз обнаруживают только у десятой части больных. Максимально высокий процент обусловлен злокачественными процессами яичников — на момент выявления болезни две из трёх пациенток уже имеют опухолевые узлы на брюшине.
Вероятность канцероматоза зависит от степени агрессивности раковых клеток и величины первичной опухоли, так при тотальном инфильтративном раке желудка его выявляют чаще, чем при локальном процессе, не разрушившем наружную серозную оболочку органа.
Тем не менее, ни при одном из злокачественных процессов любой локализации, будь то рак молочной железы или простаты, лёгкого или носоглотки, не исключается внутрибрюшинное метастазирование. Посмертно канцероматозные изменения выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Для сарком такая локализация метастазов нетипична, саркоматоз брюшины констатируется едва ли у трёх из сотни больных. В редчайших случаях совершенно доброкачественные по гистологии муцинозные аденома аппендикса и цистаденома яичников тоже способны привести к обсеменению брюшины с выработкой гелеобразного секрета.
У одного из миллиона, и много чаще это будет женщина, выявляют муцинозную аденому аппендикса или муцинозную цистаденому яичников, в последующем часто приводящие к обсеменению брюшины. Распространение аденомуцинозных клеток в полости живота с выработкой гелеобразного секрета именуют уже «псевдомиксома», зачастую при в этой стадии заболевания не удаётся определить первоисточник опухоли.
Диагностика канцероматоза брюшины
Не представляет трудности выявление опухолевого поражения брюшины при асците, в отсутствии выработки патологического секрета диагностика опирается на визуализацию — УЗИ и КТ с контрастированием.
При УЗИ на внутреннем листке, прилежащем к мышцам брюшной стенки, в норме очень тонком и незаметном, можно увидеть напластования толщиной в несколько сантиметров, практически не прослеживаются только мелкие узелки.
КТ с контрастным усилением много информативнее УЗИ, способно выявить сантиметровые образования. Наиболее точный диагностический метод — лапароскопия. Это обследование обязательно при карциноме желудка, при раке яичников предпочтительна операция — диагностика и лечение одновременно.
При лапароскопии или пункции получают асцитическую жидкость для исследования и определения первоисточника злокачественного процесса. Из экссудата выделяют осадок, который изучают под микроскопом и проводят специфические реакции — ПЦР и ИГХ.
ПЭТ на этапе первичной диагностики не всегда информативна, поскольку далеко не все злокачественные клетки легкого, печени, почек способны накапливать изотопы.
Вне всяких сомнений, самый оптимальный метод диагностики — получение кусочка опухолевой ткани для исследования. Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.
Стадии канцероматоза брюшной полости
Стадирование перитонеального канцероматоза нельзя назвать точным, все классификации приблизительны в определении объёма повреждений и не уточняют локализацию узлов. Зачастую, стадирование даёт общее представление о прогнозе эффективности лечебных мероприятий, нежели информирует о настоящем состоянии внутри полости живота.
Разработанная японскими специалистами градация опухолевого распространения по трём степеням, учитывает общий объём поражения, без числа и размеров очагов:
- P1 — ограниченное;
- P2 — разделённые нормальной тканью очаги;
- P3 — множество узлов.
Во время операции хирурги определяют индекс перитонеального канцероматоза (РСI), измеряя узелки в 13 регионах полости, общая сумма баллов влияет на тактику лечения, в первую очередь, на возможность удаления брюшины — перитонэктомию и целесообразность внутриполостной химиотерапии. При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
Наибольшее представление о размерах ракового повреждения даёт стадирование по степеням:
- 0 — в полости чисто,
- I — в одной анатомической зоне узелки до 5 мм,
- II — множественные узелки до 5 мм,
- III — локальное поражение 0.5–2 см,
- IV — 2-х сантиметровые узелки.
Течение канцероматоза определяется не столько размером метастатического узла, сколь клеточной потенцией к прогрессии и выработке асцитической жидкости, общей площадью опухолевой трансформации и клиническими проявлениями.
Симптомы канцероматоза брюшной полости
Перитонеальный канцероматоз небольшой протяжённости может не проявлять себя симптомами, особенно в отсутствии выработки асцитической жидкости. С другой стороны, жидкость может продуцироваться и при отсутствии видимых метастазов. Как правило, симптоматика неспецифична, и в разном наборе могут отмечаться:
- меняющие локализацию болезненные ощущения, а чаще — непонятный дискомфорт в полости живота;
- нарастающая слабость до утраты работоспособности;
- потеря веса при стабильном диетическом режиме;
- прогрессирующее снижение аппетита;
- функциональные нарушения со стороны органов ЖКТ.
Дальнейшее нарастание раковых повреждений сопровождается опухолевой интоксикацией, сдавление желудка опухолевыми узлами осложняется тошнотой и рвотой, кишечника — запорами и поносами с усугублением частичной непроходимости. Распад крупных узлов может вызывать боли и повышение температуры.
Асцит нарушает процесс дыхания и вызывает сердечную недостаточность с постоянными отёками, а частая эвакуация патологической жидкости приводит к белковой недостаточности.
Как лечат канцероматоз брюшины
Ни один из современных методов лечения канцероматоза не гарантирует радикального удаления опухоли, не способен излечить, но может улучшить состояние и существенно продлить жизнь.
Хирургическое лечение канцероматоза технически сложное для оперирующей бригады и трудно переносимое пациентом, поскольку предполагает удаление первичного рака, увеличенных лимфатических узлов, сальниковых сумок и всех видимых опухолевых образований вместе с брюшиной.
Перитонэктомия — многоэтапное вмешательство, включающее удаление нескольких органов и отделов брюшной полости. В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
Стандарт терапии канцероматоза — химиотерапия системная и локальная — внутрибрюшинная после удаления асцита или через лапаропорт, установленный во время операции.
Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Какие методики терапии дают лучший результат
Наиболее высокий эффект демонстрирует комбинация трёх методов лечения рака:
- Операция с максимально возможным удалением злокачественных новообразований — циторедукция.
- Локальная внутрибрюшинная гипертермия.
- Внутриполостное введение химиопрепаратов.
Использование во время хирургического вмешательства интраперитонеальной гипертермической химиотерапии (ИГХТ или HIPEC) позволяет максимально долго поддерживать очень высокую концентрацию цитостатика непосредственно в зоне поражения и усилить лекарственное воздействие нагреванием тканей. При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
Технология ИГХТ такова: в течение полутора часов внутрь брюшной полости под давлением подаётся нагретый химиопрепарат в дозе, существенно превышающей максимально разрешённую для внутривенного введения. За счёт локального использования изменяется спектр токсических реакций, исключается опасное для жизни повреждение кроветворения, но возможна боль в животе и временное нарушение функционирования органов ЖКТ.
Интраоперационная фотодинамическая терапия (ФДТ), когда на выявленные с помощью фотосенсибилизатора очаги опухоли воздействуют лазером, уступает HIPEC по результативности, поскольку лазером невозможно проникнуть во все «закоулки» брюшной полости. Тем не менее, целесообразно использование фотодинамической терапии при крупных и немногочисленных раковых узлах.
Прогноз при канцероматозном поражении
На течение процесса влияет объём поражения на момент начала терапии, степень злокачественности опухоли, в свою очередь определяющая чувствительность к химиотерапии. Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Однозначно революционные результаты в клинических испытаниях показала только HIPEC. После интраоперационной гипертермической ХТ пятилетняя выживаемость при канцероматозе рака желудка выросла максимально до 20%, все прочие методы исключали столь долгое дожитие. При раке толстой кишки с метастазами по брюшине каждый третий пациент прожил более 5 лет, при карциноме слепой кишки и аппендикса — шестеро из десяти вступили во вторую пятилетку жизни.
Список литературы
- Давыдов М.И., Тер-Ованесов М.Д., Буйденок Ю.В. с соавторами/ Гипертермическая интраоперационная интраперитонеальная химиотерапия при раке желудка: существует ли реальная возможность изменить прогноз? // Вестник РОНЦ им. Н. Н. Блохина РАМН; 2010 Т. 21; № 1
- Степанов И.В., Падеров Ю.М., Афанасьев С.Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5
- Akiyama H., Yamaoka H., Tanaka K., et al./ Continuous hyperthermic peritoneal perfusion for peritoneal dissemination of gastric cancer // Hepatogastroenterology; 1998.
- Bozzetti F., Bonfanti G., Morabito A., et al/ A multifactorial approach for the prognosis of patients with carcinoma of the stomach after curative resection // Surg. Gynecol. Obstet.; 1986.
- Cotte E., Passot G., Gilly F.N., Glehen O. /Selection of patients and staging of peritoneal surface malignancies // World J. Gastrointest. Oncol.; 2010; Vol. 2.
- Chua T.C., Moran B.J., Sugarbaker P.H., et al. /Early- and longterm outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy// J. Clin Oncol 2012.
- Deraco M., Santoro N., Carraro O., Inglese M.G., et al./ Peritoneal carcinomatosis: feature of dissemination. A review // Tumori; 1999.
- Lansom J., Alzahrani N., Liauw W., Morris D.L. /Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy for Pseudomyxoma Peritonei and Appendix Tumours // Indian J Surg Oncol. 2016 Jun.
- Sugarbaker P.H./ Overview of peritoneal carcinomatosis // Cancerologia; 2008.
Источник
