Каскад каррера при раке желудка
Важным аспектом в диагностике хронического гастрита (ХГ), является определение предракового перерождения желудочного эпителия.
Важным аспектом в диагностике хронического гастрита (ХГ), является определение предракового перерождения желудочного эпителия.
Исходя из проведенных исследований Р.Correa в 1988, были сделаны выводы, что слизистая оболочка желудка изменяется в определенной патологической последовательности, от ее физиологического состояния до проявления рака.
Желудочный канцерогенез — это очень сложный, последовательный и многостадийный процесс. Таким образом, ХГ прогрессирует с ростом атрофии и кишечной метаплазии. У определенного числа пациентов метаплазированный эпителий становится подверженным к геномным и фенотипическим модификациям с образованием дисплазии с возможным перерождением в инвазивную опухоль.
На сегодняшний день, атрофию и дисплазию слизистой оболочки желудка считают предраковыми изменениями, то есть это те изменения, у которых высокий риск перерождения в рак желудка.
Атрофия слизистой желудка, причины ее возникновения и этапы развития.
Во время атрофических изменений слизистой желудка, наблюдается потеря желудочных желез с заменой на метаплазированный эпителий или фиброзную ткань. Данный процесс возникает в результате длительно текущего воспалительного процесса слизистой, и как следствие, нарушается нормальная регенерация клеток, железы начинают погибать.
Существует два варианта развития атрофии при наличии Helicobacter pylori:
- В результате прямого повреждения или воспалительного ответа, происходит разрушение железистого аппарата.
- Вследствие избирательного разрушения клеток железистого эпителия с сбережением стволовых клеток.
Бактериальные протеазы, которые высвобождаются за счет активированных нейтрофилов, способны уничтожать стволовые клетки и железистый эпителий. Также вырабатываемые аутоантитела взаимодействуют с эпитопами протонной помпы париетальных клеток.
Непосредственное травмирование эпителия продуктами жизнедеятельности бактерий не совсем разъясняет распространение и усиление атрофического процесса желез, так как бактерии расположены на поверхностном и ямочном эпителии.
В результате уменьшения железистой ткани наблюдается ее замещение фиброзной тканью. Во время атрофических проявлений, возникает потеря функционально активных специализированных клеток, клеточные элементы фундальных желез замещаются на тубулярные железистые структуры из шеечных мукоцитов. Такого рода атрофия наблюдается у пациентов с аутоиммунным гастритом.
Существует взаимосвязь между возрастом пациента и тяжестью развития атрофии слизистой желудка, чем пациент старше, тем тяжелее и быстрей развивается атрофический процесс.
В таких случаях можно наблюдать, как слизистая оболочка желудка антрального типа переходит на область тела желудка со смещением в проксимальном направлении границы тело/антрум. Иногда, данная пилоризация желез тела желудка возникает мультифокально по всей слизистой оболочки желудка. Эта атрофия зачастую ярко выражена на малой кривизне в участке инцизуры.
Атрофический процесс нельзя полностью связывать с процессами старения организма, так как у пожилых людей при нормальной кислотности, проявления атрофии не наблюдаются. Пусковым механизмом здесь выступает присоединение Helicobacter pylori, также атрофия может возникать в результате аутоиммунного гастрита и продолжительного рефлюкс-гастрита. Механизмы развития гастрита, прежде всего, зависят от этиологии.
Утрата желез, при аутоиммунном (тип А) гастрите связана с антителами, хотя нельзя исключать и воздействия Т- клеточной цитотоксичности.
При ассоциированном повреждении слизистой оболочки желудка бактериями Helicobacter pylori, был выявлен феномен молекулярной мимикрии. У ста исследуемых пациентов с Helicobacter pylori были обнаружены аутоантитела, которые взаимодействовали с желудочными антигенами. Максимальная активность аутоантител проявлялась в зоне эпителиоцитов желудочных желез, также была обнаружена корреляция между лимфоцитарной инфильтрацией в зоне шеечных эпителиоцитов при наличии аутоантител.
Исследователи выдвинули предположение, что формированию антител способствует перекрестная реакция с антигенными детерминантами муцина, которые образуются в процессе регенерации желудочного эпителия.
Стоит отметить, что у пациентов с аутоантителами чаще находили атрофию желез и лимфоцитарную инфильтрацию, чем у пациентов без аутоантител с наличием Helicobacter pylori. Таким образом, можно сделать вывод, что хроническая аутоиммунная агрессия против эпителия желудка может быть причиной возникновения атрофии и метаплазии в слизистой оболочке желудка при хеликобактерном гастрите. Степень проявления антигенной мимикрии влияет на увеличение атрофии, но это относится не ко всем случаям.
Атрофия при рефлюксе желчи возникает как следствие повторного эрозирования слизистой оболочки желудка из-за воздействия на нее желчными кислотами или лизолецитином в сочетании с кислотой, также причиной может быть хронический реактивный или химический гастрит.
Источник
Цель обзора. Анализ каскада Correa. Обзор морфологических типов атрофии, кишечной метаплазии и дисплазии слизистой оболочки желудка (СОЖ) как этапов гастроканцерогенеза. Основные положения. Каскад Correa – последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ. Этапы каскада Correa рассматриваются как предраковые изменения СОЖ, пусковым механизмом развития которых является обсеменение СОЖ Нelicobacter pylori (Н. pylori). Благодаря разработанным системам оценки состояния СОЖ при хроническом гастрите, а также проводимым молекулярно-биологическим и генетическим исследованиям каскад Correa получил четкую морфологическую характеристику развития на каждом этапе, что позволяет разработать последовательный план ведения пациентов с целью канцерпревенции. Заключение. Каскад Correa – последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ. Эрадикационная терапия у больных с предопухолевыми изменениями СОЖ позволяет снизить риск развития рака желудка. Пациентам с запущенным H. pylori гастроканцерогенезом необходимы динамическое наблюдение и лечение в зависимости от уровня выявленных морфологических изменений.
Множественные интерпопуляционные исследования, проведенные в течение первого десятилетия XXI в., показали, что с нарастанием предопухолевых изменений нарастает и заболеваемость раком.
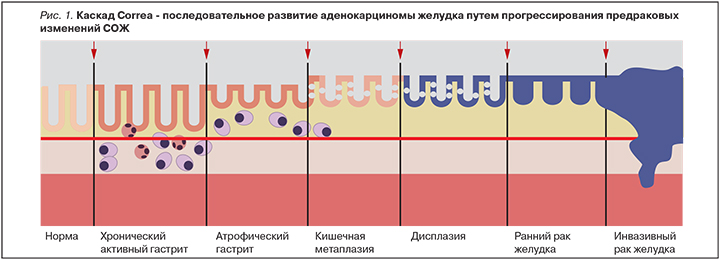
В 1988 г. Р. Correa постулировал последовательность патологических изменений в слизистой оболочке желудка (СОЖ) при хроническом гастрите (ХГ) от нормального состояния до возникновения рака (рис. 1).

Этапы каскада Correa – атрофия, кишечная метаплазия (КМ) и дисплазия – рассматриваются как предраковые изменения СОЖ. Впоследствии процесс перестройки СОЖ был модифицирован P. Correa с включением роли Н. pylori в начало последовательности патологических изменений.
«Золотым стандартом» диагностики патологических изменений СОЖ на современном уровне развития медицинской науки и практики является эзофагогастродуоденоскопия с применением витальных красителей или использованием режимов увеличительной ZOOM- и узкоспектральной NBI-эндоскопии, что позволяет произвести прицельную биопсию с высокой вероятностью выявления изменений на раннем этапе развития.
В настоящее время под термином «каскад Correa» понимают последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ.
В 2005 г. двое патологов, M. Rugge (Италия) и R. Genta (США), предложили использовать новую систему классификации ХГ, оценки его степени и стадии. Под степенью гастрита понималась выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией — выраженность атрофии. Данная система получила название международной классификации ХГ (Сиднейская система и ее Хьюстонская модификация [10]).
В 2008 г. была сформирована новая международная группа, включающая ряд известных экспертов-патологов и гастроэнтерологов-клиницистов – Atrophy Club, которая разработала систему определения стадий ХГ под названием OLGA и OLGIM [10, 11, 12]. В ней использован интегральный подход с оценкой гистологической выраженности атрофии в антральном отделе и теле желудка с определением количества баллов в каждом биоптате.
Благодаря разработанным системам оценки состояния СОЖ при ХГ, а также проводимым молекулярно-биологическим и генетическим исследованиям каскад Correa получил четкую морфологическую характеристику развития на каждом этапе [8, 10].
Согласно предложенной модели, ХГ прогрессирует с развитием атрофии и КМ. А при определенных геномных изменениях у лиц с метаплазированным эпителием происходит развитие дисплазии с возможным прогрессированием в инвазивную опухоль.
ОБСЕМЕНЕНИЕ НELICOBACTER PYLORI
Главной морфологической особенностью хеликобактерного гастрита (синонимы: хронический антральный гастрит, гастрит типа В) является наличие на СОЖ самих Н. pylori, которые выявляются не только в бактериальной форме, но и в виде кокков.
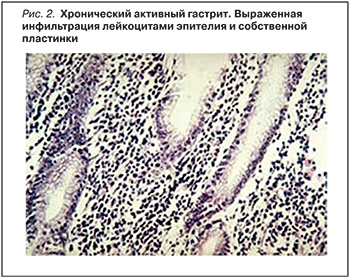 Первым этапом развития инфекции является колонизация СОЖ бактериями с последующим преодолением кислотного и слизисто-бикарбонатного барьеров желуд…
Первым этапом развития инфекции является колонизация СОЖ бактериями с последующим преодолением кислотного и слизисто-бикарбонатного барьеров желуд…
Галина Вячеславовна Белова, д.м.н., зам. главного врача по амбулаторно-поликлинической работе, зав. поликлиникой Многопрофильного медицинского центра Банка России. Адрес: 118791, Москва, Севастопольский пр-т,
д. 66. Тел.: (495) 771-98-60. E-mail: belovagv@inbox.ru
Оксана Сергеевна Руденко, врач-эндоскопист эндоскопического отделения Многопрофильного медицинского центра Банка России. Адрес: 118791, Москва, Севастопольский пр-т, д. 66. Тел.: (495) 676-82-28.
E-mail: rudenkoos@mail.ru
Источник
- Архив журнала
/ - 2018
/ - №2
Каскад Correa: современное состояние проблемы (литературный обзор)
Г.В. Белова, О.С. Руденко
Многопрофильный медицинский центр Банка России
Цель обзора. Анализ каскада Correa. Обзор морфологических типов атрофии, кишечной метаплазии и дисплазии слизистой оболочки желудка (СОЖ) как этапов гастроканцерогенеза. Основные положения. Каскад Correa – последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ. Этапы каскада Correa рассматриваются как предраковые изменения СОЖ, пусковым механизмом развития которых является обсеменение СОЖ Нelicobacter pylori (Н. pylori). Благодаря разработанным системам оценки состояния СОЖ при хроническом гастрите, а также проводимым молекулярно-биологическим и генетическим исследованиям каскад Correa получил четкую морфологическую характеристику развития на каждом этапе, что позволяет разработать последовательный план ведения пациентов с целью канцерпревенции. Заключение. Каскад Correa – последовательное развитие аденокарциномы желудка путем прогрессирования предраковых изменений СОЖ. Эрадикационная терапия у больных с предопухолевыми изменениями СОЖ позволяет снизить риск развития рака желудка. Пациентам с запущенным H. pylori гастроканцерогенезом необходимы динамическое наблюдение и лечение в зависимости от уровня выявленных морфологических изменений.
Литература
Об авторах / Для корреспонденции
Галина Вячеславовна Белова, д.м.н., зам. главного врача по амбулаторно-поликлинической работе, зав. поликлиникой Многопрофильного медицинского центра Банка России. Адрес: 118791, Москва, Севастопольский пр-т,
д. 66. Тел.: (495) 771-98-60. E-mail: belovagv@inbox.ru
Оксана Сергеевна Руденко, врач-эндоскопист эндоскопического отделения Многопрофильного медицинского центра Банка России. Адрес: 118791, Москва, Севастопольский пр-т, д. 66. Тел.: (495) 676-82-28.
E-mail: rudenkoos@mail.ru
Похожие статьи
- Патогенетические механизмы развития предраковых изменений желудка у пациентов с синдромом Марфана
- Оценка клинического статуса пациента с дисплазией соединительной ткани: прогностически ориентированный подход
Источник
д. м. н. Белова Г. В. – зав. отделением эндоскопических методов исследования Медицинского центра Банка России
к. м. н., доцент Мельченко Д. С. – зав. лабораторией срочной гистологии и цитологии Медицинского центра Банка России
к. м. н. Карпова Е. С. — старший научный сотрудник эндоскопического отделения ФГБУ Минздравсоцразвития России МНИОИ им. Герцена
г. Москва
Множественные интерпопуляционные исследования продемонстрировали, что с нарастанием предопухолевых изменений, нарастает и заболеваемость раком. Обеспечение постоянства структуры слизистой оболочки желудка (СОЖ) возможно при строгой координации процессов пролиферации и гибели клеток. Клеточное обновление регулируется по принципу отрицательной парадной связи: на утрату части популяции генеративная зона отвечает усиленным новообразованием клеток ускорением их миграции. Незрелые клетки СОЖ погибают под влиянием апоптоза – процесса, направленного на поддержание гомеостаза за счет элиминации клеток, утративших свои функции и представляющих опасность для организма. Согласно каскаду Correa, основным состоянием, предшествующим раку является кишечная метаплазия (КМ), которая определяется как очаговая трансформация нормальных эпителиоцитов СОЖ в абсорбтивные эпителиальные клетки кишечного типа и бокаловидные клетки. В настоящее время установлена роль Helicobacter рylori (Hp) в пренеопластической трансформации СОЖ: Hp вызывает геномную нестабильность, индуцировав процессы атрофии, кишечной метаплазии (КМ) и дисплазии (Д), однако, конкретный механизм вовлечения возбудителя неизвестен.
Цель исследования:
Изучить последовательность молекулярно-биологических событий, обеспечивающих прогрессию предопухолевых процессов в ранний рак желудка.
Материалы и методы:
С этой целью использовали иммуногистохимический метод (ИГХ) для измерения уровня белков, связанных с канцерогенезом в биопсийном материале, полученном при проведении эзофагогастродуоденоскопии.
Забор биопсийного материала производился прицельно из наиболее измененных участков слизистой. Исследование проводилось с 2005 по 2011год. Применялись эндоскопические диагностические методы витального окрашивания слизистой 0,2%раствором метиленового синего, ZOOM-, NBI- и FICE-эндоскопия. Материалом исследования послужили фрагменты СОЖ 173 пациентов с различной степенью патологических изменений СОЖ в возрасте от 36 до 78лет, из них 100 мужчин и 73 женщины (табл.1). Критерием для отбора пациентов в группы были эндоскопически выявленные и гистологически подтвержденные изменения СОЖ в сочетании с контаминацией Hр.
Таб. 1. Характеристика групп пациентов до начала лечения
| Диагноз | число |
| Хронический гастрит (ХГ) | 30 |
| Хронический атрофический гастрит (ХАГ) | 42 |
| Кишечная метаплазия (КМ) | 74 |
| Дисплазия легкой степени (Д1) | 11 |
| Дисплазия тяжелой степени (Д2) | 11 |
| Ранний рак желудка (РР) | 5 |
| Контрольная группа | 30 |
| Всего | 203 |
Все пациенты проходили обследование в динамике в соответствии со сроками наблюдения, утвержденным Американским обществом гастроэнтерологов и лечение соответственно утвержденным международным стандартам. Все пациенты получали консервативную терапию, включающую ингибиторы протонной помпы, антигеликобактерную терапию (АГБТ) в соответствии с рекомендациями Маастрихт-3, циторотективную и антиоксидантную терапию. Пациентам с РР (во всех случаях не было прорастания в подслизистый слой) и 3 пациентам с Д2 (при неэффективности консервативной терапии и сохраняющихся тяжелых диспластических изменениях через 1месяц) была проведено эндоскопическое внутрипросветное лечение: мукозэктомия в сочетании с аргоноплазменной коагуляцией (5пациентов) и фотодинамической терапией (3пациента). В качестве контрольной группы использовали архивный материал гастробиопсий нормальной СОЖ 30пациентов в возрасте от 28 до 52 лет (15 мужчин и 15 женщин) при отрицательном анализе на Нр.
Нами была исследована экспрессия ряда антигенов, позволяющих судить об интенсивности пролиферации (PCNA, Ki-67, p53), реализации процессов апоптоза (bcl-2, Bax), наличии онкопротеинов (C-erb B2), особенностях перестройки СОЖ (Muc-2, Muc-5AC) до начала лечения и через 1,5месяца после его окончания.
Результаты:
В контрольной группе пациентов с гистологически нормальной СОЖ были выявлены сбалансированные показатели пролиферации и апоптоза, отсутствие или низкие показатели онкопротеинов, выраженная экспрессия Muc-5AC и спорадическая экспрессия Muc-2. В исследуемых группах до начала лечения по мере прогрессирования изменений слизистой в соответствии с каскадом Correa отмечалось достоверное прогрессивное увеличение показателей пролиферации, угнетение процессов апоптоза в виде дискоординации белков bcl-2, Bax, нарастание % выявляемости онкопротеинов (C-erb B2), прогрессивное снижение экспрессии Muc-5AC и нарастание Muc-2 (p<0,01 по сравнению с нормальной СОЖ).
При исследовании через 1,5 месяца после окончания курса лечения статистически по данным эндоскопического исследования с морфологической верификацией диагноза группы были представлены следующим образом (табл.2). Эррадикация Нр была достигнута во всех случаях.
Таб. 2. Характеристика групп пациентов после лечения
| Диагноз | число |
| ХГ | 45 |
| ХАГ | 35 |
| КМ | 74 |
| Д1 | 19 |
| Контрольная группа | 30 |
| Всего | 203 |
По данными ИГХ исследования биопсийного материала также отмечалась положительная динамика: достоверное снижение средних значений показателей пролиферации, активизация процессов апоптоза, снижение % выявляемости онкопротеинов (C-erb B2), увеличение экспрессии Muc-5AC и снижение Muc-2 (p<0,01 по сравнению с показателями до начала лечения). Однако у всех пациентов РР и у 5 пациентов с Д2 сохранялось достоверное (p<0,01) сниженное значение Muc-5AC и дискоординация белков bcl-2, Bax, что позволило предположить наличие стойкого повреждения ДНК. Эти пациенты могут быть отнесены в группу с высоким риском развития метахронного рака желудка и требуют постоянного динамического наблюдения, не реже 1 раза в полгода, с проведением тщательного эндоскопического осмотра, желательно с применением методов ZOOM-, NBI- или FICE-эндоскопии и прицельной множественной биопсией из всех подозрительных участков слизистой.
Выводы:
- Инфекция Hр нарушает баланс между процессами пролиферации и апоптоза в СОЖ и является установленным фактором риска развития рака.
- Эррадикационная терапия у больных с предопухолевыми изменениями СОЖ позволяет скорректировать экспрессию белка Bax, снизить пролиферацию эпителиоцитов и тем самым риск развития рака желудка. Однако индуцироваванный Hp гастроканцерогенез может сохраняться и после проведенного курса лечения.
- Пациенты с сохраняющимися высокими показателями канцерогенеза требуют постоянного динамического наблюдения, не реже 1 раза в полгода с проведением тщательного эндоскопического осмотра, желательно с применением методов ZOOM-, NBI- или FICE-эндоскопии и прицельной множественной биопсией из всех подозрительных участков слизистой.
Источник
