Молекулярная диагностика рака желудка

Исследование на онкомаркеры
Диагностировать рак желудка без применения сложных и не всегда легко переносимых исследований, к сожалению, пока невозможно. Хотя распространённой практикой «диспансеризации» уже стало исследование онкомаркеров. К сожалению, этот метод трудно отнести к высокочувствительным (чувствительность этих тестов не превышает 50%). И все же повышение значений СА 72-4, РЭА, СА 19-9 служит сигналом к обязательному углубленному обследованию и исследованию увеличенного показателя в динамике.
Большее значение онкомаркеры имеют при оценке распространенности процесса и при возникновении рецидива заболевания после успешного лечения.
Симптомы
Для ранних стадий рака желудка характерно обилие паранеопластических симптомов, часто маскирующих развитие опухоли и уводящих в сторону от правильного диагноза.
- Один из самых ярких симптомов — черный акантоз, при котором развивается сопровождающаяся ворсинчато-бородавчатыми разрастаниями темная пигментация кожи подмышечных впадин и других крупных кожных складок. Иногда черный акантоз на несколько лет опережает проявления самой опухоли.
- Полимиозит, дерматомиозит, кольцевидная эритема, пемфигоид, не уступающий лечению тяжелый себорейный кератоз также требуют углубленного обследования с обязательным проведением эндоскопии желудка.
- Бывают случаи, когда выработка клетками опухоли глюкокортикоидных гормонов, которые в норме синтезируются надпочечниками, вызывает даже формирование т.н. эктопического синдрома Кушинга. При нем жировая ткань откладывается преимущественно на лице и животе (так называемый матронизм), повышается артериальное давление, развивается склонность к переломам костей и акне.
- Частым паранеопластическим проявлением рака желудка, впрочем, как и многих других опухолей является мигрирующий тромбофлебит (синдром Труссо).
- Тяжелее всего заподозрить развитие рака желудка, когда у пожилых людей вдруг начинает быстро прогрессировать деменция, или появляются нарушение координации движений, изменение походки, нарушение равновесия.
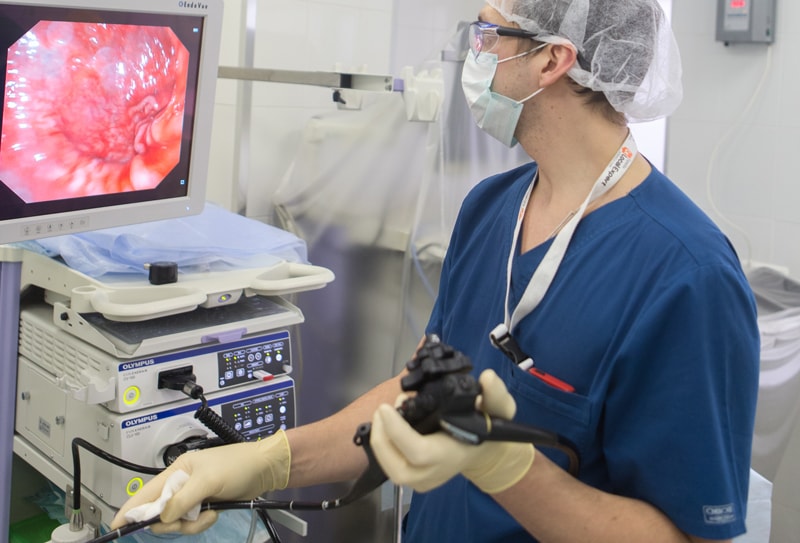
Ситуация усугубляется сходством клинической, рентгенологической и эндоскопической картины при изъязвленных опухолях и язвенной болезни. Поэтому самым чувствительным способом диагностики считается эзофагогастродуоденоскопия (ЭГДС, гастроскопия) с множественной биопсией, обязательной у пациентов, относящихся к группе риска. ЭГДС позволяет одновременно:
- выполнить биопсию и провести дальнейшее гистологическое и цитологическое исследование с целью морфологической верификации новообразования и диагностики;
- осуществить лечебные манипуляции по коагуляции полипа с его удалением при небольших размерах (до 2 см);
- остановить кровотечение;
- провести зонд для кормления и т.д.
При угрозе кровотечения используется менее травмирующая браш-биопсия. В сомнительных случаях назначают повторную биопсию через 8-12 недель. Но даже этот способ диагностики дает правильный ответ только в 90% случаев и может дать ложно отрицательный результат при инфильтративном росте опухоли (такой рак называют скирр).
Кроме рака в желудке могут развиваться и опухоли из других клеток, требующие совершенно иных подходов к лечению (саркома, лимфома). Единственный способ разобраться в этом — множественные биопсии при проведении ЭГДС. Для выявления измененных участков тканей, не обнаруживаемых при обычном осмотре, используют т.н. хромогастроскопию. Этот метод позволяет проводить диагностику опухолей на ранних стадиях благодаря тому, что при окрашивании слизистой оболочки желудка по время процедуры специальными красителями (конго-рот/метиленовым синим, индигокамином) и даже раствором Люголя опухолевые ткани выглядят иначе, чем здоровые.
Когда необходимо проведение ЭГДС (гастроскопии)?
Существуют заболевания, считающиеся предраковыми, при которых необходимо периодическое обследование независимо от наличия симптомов. К ним относят:
- хронический атрофический гастрит с т.н. кишечной метаплазией особенно при наличии хеликобактерной инфекции;
- язвенная болезнь желудка;
- пищевод Баррета;
- дефицит витамина В12 (пернициозная анемия);
- аденоматозные полипы желудка;
- гипертрофическая гастропатия.
Операции на желудке в связи с доброкачественными новообразованиями, перенесенные более 10-лет назад, и отягощенная наследственность также относятся к ситуациям, требующим пристального наблюдения.
Вы должны регулярно наблюдаться с обязательным регулярным проведением ЭГДС, если у ваших родственников диагностировались:
- рак органов желудочно-кишечного тракта,
- семейный аденоматозный полипоз толстой кишки,
- синдром Гарднера,
- синдром Пейтца-Егерса,
- семейный ювенильный полипоз,
- синдром Ли Фраумени.
С развитием генетики стали известны некоторые гены, определенные мутации которых при особых условиях приводят к раку желудка.
Существуют и регионы, в которых, видимо в результате особенностей питания или экологии, заболеваемость существенно выше средних показателей (Япония, некоторые страны Европы, Скандинавия, Южная и Центральная Америка, Китай, Корея, страны бывшего СССР). Людям, длительно живущим в этих районах, надо внимательнее относиться к своему здоровью и периодически проводить ЭГДС. Сигналом к обязательному обследованию может послужить такой показатель как концентрация пепсиногена сыворотки крови (в норме — меньше 70 нг/мл) и соотношение его фракций (ПГ1/ПГ2).
При невозможности проведения ЭГДС, например, из-за сопутствующих заболеваний, может быть проведена полипозиционная рентгенография с двойным контрастированием бариевой взвесью и воздухом. Этот метод обладает, правда, гораздо меньшей чувствительностью при ранних стадиях заболевания и не дает возможности морфологической верификации. Дополнительно используют МСКТ и УЗИ, однако точность последнего исследования даже при опытном исследователе очень зависит от технических возможностей аппарата, особенностей телосложения и правильности подготовки пациента.
Лапароскопическая диагностика желудка
При подозрении на распространение опухоли по брюшной полости возможно проведение диагностической лапароскопии и лапароскопического УЗИ, позволяющих подробно изучить процесс в непосредственной близости.
Этот метод позволяет осмотреть поверхности печени, передней стенки желудка, париетальной (выстилающей стенки брюшной полости) и висцеральной (покрывающей органы) брюшины с проведением при необходимости биопсии. В некоторых случаях эти данные принципиально важны для выбора лечения.

Прогноз при раке желудка
Прогноз зависит от количества пораженных лимфатических узлов и уровня поражения лимфатических коллекторов, глубины прорастания опухоли в стенку желудка, стадии процесса, типа роста и типа самой опухоли. По данным МНИОИ им. П.А.Герцена 5-летняя выживаемость при диагностике рака желудка на ранней стадии и быстро начатом лечении достигает 85-90%. В случае более позднего выявления ещё резектабельной опухоли — 11-54%, и даже в случае выявления рака на IV стадии лечение позволяет обеспечить 7% выживаемость больных в течение 5 лет.
Цены в Европейской клинике на диагностику рака желудка
- ЭДГС высокой четкости с цифровой записью, диагностическая — от 14300 руб.
- Рентгеноконтрастное исследование пищевода и желудка — 20700 руб.
- Ультразвуковое исследование брюшной полости (печень, желчный пузырь, желчные протоки, селезенка, поджелудочная железа), в т. ч. с определением уровня свободной жидкости — 7000 руб.
- Диагностическая лапароскопия — 57500 руб.
Но речь ведь не только о продлении жизни. Цель лечения в большинстве даже далеко зашедших случаев в улучшении её качества, избавлении человека от множества тягостных симптомов, в том числе болей, обеспечении ему возможности вести обычный образ жизни, заниматься важными для него делами, общаться с близкими.
Современные методы лечения рака желудка, применяемые в Европейской клинике, позволяют проводить лечение с минимальными сроками госпитализации и использованием малоинвазивных методик, улучшающих не только прогноз для жизни, но и качество самой жизни наших пациентов.
Источник

Онкомаркеры — это особые вещества, которые выявляются в анализах крови или мочи у пациентов со злокачественными новообразованиями. На заре изучения этого направления предполагалось, что онкомаркеры будут использоваться для ранней диагностики и скрининга рака.
На деле все оказалось намного сложнее, например повышение уровня многих онкомаркеров не связано со злокачественными процессами, и более того, может проявляться в норме у здоровых людей. Также было выявлено, что у многих пациентов с уже установленным диагнозом злокачественного новообразования, уровень онкомаркеров остается в норме или повышается незначительно.
На сегодняшний день определение онкомаркеров для ранней диагностики используется для ограниченного количества нозологий. В основном их применяют для дополнительной диагностики и динамического наблюдения эффективности лечения и прогрессирования заболевания.
Какие онкомаркеры используются для диагностики рака желудка
CA-19-9
Этот маркер вырабатывается эпителиальными клетками органов желудочно-кишечного тракта. Соответственно, при опухолях, происходящих из этих клеток, уровень СА19-9 существенно повышается. Больше всего показатели изменяются при раке поджелудочной железы, но могут увеличиваться и при раке толстой кишки, печени, желчных протоков и желчного пузыря, панкреатитах, муковисцидозах. Таким образом, учитывая низкую чувствительность и специфичность, данный показатель для самостоятельной диагностики и мониторинга не применяется.
РЭА
РЭА (раково-эмбриональный антиген) — белок, тканевой маркер онкопатологии. Используется при диагностике опухолей толстой кишки, но может быть результативен и при раке желудка. В норме его показатели крайне низки, но при наличии злокачественного новообразования, его уровень резко увеличивается.
СА 72-4
СА 72-4 — это гликопротеин, который располагается на поверхности эпителия органов ЖКТ во время внутриутробного развития человека. У взрослых людей он появляется при колоректальном раке, раке желудка и других злокачественных опухолях. Однако у 6,7% пациентов его увеличение было выявлено и при наличии доброкачественных опухолей.
Чувствительность при раке желудка составляет 40-46%, причем чем выше показатель онкомаркера, тем больше распространен злокачественный процесс, т.е. имеется корреляция со стадией. После радикального удаления рака, показатель СА 72-4 приходит в норму в течение 3-4 недель. Что касается метастазов, то данный онкомаркер рака желудка более чувствителен, чем РЭА или СА 19-9. Определение СА 72-4 проводится для оценки шансов на выживание у больных с установленным диагнозом карциномы желудка. Чем выше показатель онкомаркера, тем выше стадия заболевания.
Что показывают онкомаркеры при раке желудка
В целом, анализы на онкомаркеры рака желудка не отличаются высокой чувствительностью и специфичностью. Это значит, что нормальные значения результатов не гарантируют отсутствие опухоли, а повышенные результаты не означают наличие именно рака. Однако при повышении уровня онкомаркера в десятки раз, вероятность этого увеличивается.

Диагностическая ценность исследования онкомаркеров увеличивается при одновременном исследовании нескольких показателей, например СА 19-9 и РЭА, либо СА 72-4 и РЭА. Но для самостоятельной диагностики рака желудка их использовать все равно нельзя.
СА 19-9
Референсные значения онкомаркера СА19-9 находятся в пределах 0-34 Ед/мл. Такие показатели наблюдаются у 95% здоровых людей.
Повышение уровня онкомаркера может свидетельствовать о следующих заболеваниях:
- Рак поджелудочной железы. Чем выше уровень СА 19-9, тем более распространен патологический процесс. Наибольшая концентрация наблюдается при наличии отдаленных метастазов, т.е. на 4-й стадии заболевания.
- Рак желудка.
- Рак толстой кишки.
- Карцинома печени.
- Рак желчных протоков и желчного пузыря.
- Рак яичников.
Помимо этого, повышение уровня данного онкомаркера наблюдается при некоторых доброкачественных заболеваниях:
- Гепатит.
- Цирроз печени.
- Панкреатит.
- Желчно-каменная болезнь.
- Муковисцидоз.
РЭА
Референсные значения РЭА следующие:
- Для некурящих людей ниже 3,8 нг/мл.
- Для курящих — 0-5,5 нг/мл.
Это нормальные уровни РЭА, характерные для здоровых людей, но такой результат возможен и при наличии опухоли, нечувствительной к данному тесту.
Повышение уровня данного онкомаркера может наблюдаться как при злокачественных, так и доброкачественных заболеваниях. Злокачественные опухоли:
- Рак толстой кишки.
- Рак желудка.
- Рак легких.
- Рак молочной и поджелудочной железы.
Неонкологические заболевания:
- Цирроз печени.
- Гепатиты.
- Кишечные полипы.
- Хронические воспалительные заболевания кишечника, например, язвенный колит.
- Некоторые заболевания легких, в том числе туберкулез.
- Аутоиммунные патологии.
СА 72-4
Референсные значения онкомаркера СА 72-4 0-6,9 Ед/мл. Нормальный показатель анализа характерен для здоровых людей, повышение его значения наблюдается в следующих случаях:
- Рак желудка.
- Некоторые формы рака яичника.
- Колоректальный рак.
- Рак легких.
- Гепатиты.
- Цирроз печени.
- Киста яичника.
- Воспаления органов ЖКТ.
Показания к назначению анализа на онкомаркеры желудка
- Дополнительный метод диагностики заболевания.
- Отслеживание динамики патологического процесса (прогрессирование заболевания).
- Контроль лечения.
- Контроль развития рецидивов.
Подготовка к анализу на онкомаркеры рака желудка
Анализы на онкомаркеры рака желудка сдаются строго натощак, последний прием пищи должен быть не ранее чем за 8 часов до забора крови.
Для исследования берется венозная кровь посредством венепункции. Другой подготовки не требуется.
Надежность и достоверность результатов анализа на онкомаркеры при раке желудка
Надежность и достоверность результатов будет зависеть от следующих аспектов:
- Особенности забора материала и манипуляции с ним до доставки в лабораторию.
- Используемые для проведения анализа диагностические системы и оборудование.
- Наличие сопутствующих заболеваний, которые могут приводить к увеличению концентрации исследуемых онкомаркеров.
Для получения достоверных результатов рекомендуется сдавать анализы в аккредитованных лабораториях, в которых налажены преаналитические и аналитические этапы проведения исследований, а также проведение внутрилабораторного и внешнего контроля качества.
Интерпретация результатов онкомаркеров при раке желудка
Назначать и интерпретировать результаты анализов на онкомаркеры должен врач, который имеет опыт диагностики и лечения рака желудка. Интерпретация осуществляется на основании данных обследования, анамнеза и клинической картины. Изолированное использование онкомаркеров для скрининга или обнаружения рака желудка недопустимо.
Нормальные значение онкомаркеров желудка не гарантируют отсутствие злокачественных опухолей. Такие результаты могут быть при ранней стадии рака, когда уровень маркера еще не повысился, либо есть опухоли, которые вообще не приводят к повышению его уровня.
Повышенные результаты также требуют дополнительного обследования, поскольку могут свидетельствовать о наличии опухоли другой локализации, либо неонкологического заболевания. В сомнительных случаях исследование на онкомаркеры рака желудка назначают в динамике. Нарастание его уровня свидетельствует о наличии прогрессирующего заболевания, уменьшение уровня маркера — о выздоровлении.
Изначально очень высокие показатели онкомаркеров, особенно если их значение превышено в несколько раз, с высокой долей вероятности говорит о наличии злокачественного процесса, но не гарантирует этого на 100% и тем более не позволяет установить вид новообразования.
Наибольшей информативностью при раке желудка обладает динамическое исследование онкомаркеров. Снижение их уровня говорит об эффективно проведенном лечении, нормализация показателей отмечается после радикально проведенной операции.
Если после проведенного лечения уровень онкомаркера начинает расти, это свидетельствует либо о рецидиве заболевания, либо о его прогрессировании. Если показатели увеличиваются в десятки раз, это может свидетельствовать об отдаленных метастазах.
Причины рака желудка
Как и почему развивается рак желудка, до конца не ясно. Но было доказано воздействие некоторых факторов, при которых вероятность возникновения опухоли повышается. Сюда относят:
- Хронический атрофический гастрит, особенно на фоне гиперпластических процессов эпителия. Данное заболевание обнаруживалось у 60% больных раком желудка. При этом имело значение локализация процесса. Например, при расположении атрофии в антральной части желудка, риски развития рака увеличиваются в 18 раз, а при тотальном поражении органа — в 90 раз.
- Инфицирование Helicobacter Pylory. Вероятность развития рака желудка у таких пациентов выше в 3-4 раза по сравнению с общепопуляционными показателями.
- Особенности питания. Содержание в рационе большого количества острых, пряных, маринованных, соленых блюд, фастфуда, копченостей и жиров статистически значимо увеличивает вероятность развития опухолей ЖКТ, в том числе и желудка.
- Наличие аденоматозных полипов. Такие новообразования имеют относительно высокий риск малигнизации, поэтому их рекомендуют своевременно удалять.
- Курение.
- Наличие язвенной болезни желудка в анамнезе. При расположении язвы в теле желудка увеличивается риск развития злокачественного новообразования в 2 раза.
- Наличие операций на желудке в анамнезе. Увеличивает риск развития рака в 4 раза.
- Болезнь Менетрие, которая характеризуется гипертрофической гастропатией или гиперпластическим гигантоскладчатым гастритом.
- Пьянство и алкоголизм.
- Пернициозная анемия. Анемия со злокачественным течением, которая развивается из-за невозможности усвоения витамина В 12. также она сопровождается иммунодефицитными состояниями, что увеличивает риск развития злокачественной опухоли на 10%.
- Наследственная предрасположенность. Наличие злокачественных опухолей желудка у ближайших кровных родственников увеличивает риск развития рака данной локализации на 5-20%. Есть мнение, что именно от этого заболевания в свое время богибли Наполеон Бонапарт и его отец.
- Иммунодефицитные состояния.
- Работа с канцерогенными веществами.
Источник

Рак желудка (РЖ) – стабильный игрок на площадке онкологических заболеваний, не уступающий своих позиций в бронзе по уровню смертности от новообразований во всем мире [1]. Это связано с затрудненной диагностикой вследствие позднего появления клинических симптомов, что значительно ограничивает эффективность проводимого лечения. Удручающие результаты отражают неэффективность шаблонного подхода [2].
Увеличение объема информации об этой патологии является ошеломляющим. Ежедневно тысячи статей приносят элемент новизны, который способствует лучшему пониманию гастроканцерогенеза. Много надежд связано с поиском оптимальных биомаркеров. Современный медицинский подход к онкологическим заболеваниям является интегративным: информация из всех областей должна быть объединена, как в головоломке. Опухолевые маркеры – не что иное, как кусок этой головоломки.
Технологии профилирования экспрессии генов (одновременное определение экспрессии множества генов) способствуют появлению с большой скоростью огромного количества данных. Медицина переживает смену парадигм: унифицированная тактика уступает место персонализированному подходу, который все более модифицируется в высокоточные стратегии. В эпоху Big Data (большого объема данных) возрастает роль геномных сигнатур в диагностике, дифференциации, прогнозе и таргетной терапии РЖ. Медицинское обеспечение, которое индивидуально адаптируется с учетом разнообразия генов, условий окружающей среды, образа жизни, определяется как прецизионная (высокоточная) медицина [3]. Для эффективности работы с огромными массивами данных (акцент на генетику и омиксные технологии) необходимо создать «генетический шлюз», в роли которого могут выступать системы молекулярно-генетической классификации.
Мутационный ландшафт РЖ
Гистологически РЖ демонстрирует значительную гетерогенность и часто имеет несколько сосуществующих типов тканей, таких как хорошо развитые тубулярные структуры и единичные перстневидные клетки [4]. Впервые гистопатологическая классификация РЖ предложена в 1965 году Р. Lauren [5]. Она включает два типа аденокарцином желудка: диффузный и кишечный. Относительная частота кишечных, диффузных и недифференцированных типов составляют около 54%, 32% и 15% соответственно [6,7]. Кишечный и диффузный РЖ имеют значительные различия в этиологии, эпидемиологии, механизмах канцерогенеза, биологическом поведении и прогнозе [8, 9]. РЖ диффузного типа ассоциирован с мутацией в гене, кодирующем молекулу клеточной адгезии E-кадгерин [10, 11] и часто демонстрирует изменение экспрессии гена ras-гомологичной малой гуанозин-трифосфатазы (ras homolog family member A, RhoA) [12]; кишечный тип связан с атрофическим гастритом, КМ и инфекцией Helicobacter pylori [5]. Доказано несоответствие генетических изменений гистопатологическим типам аденокарцином желудка [13, 14]. Отсутствие хорошо зарекомендовавшей себя системы классификации рака желудка остается основным препятствием, препятствующим совершенной клинической практике.
Мутационный ландшафт РЖ был расшифрован с помощью крупномасштабного анализа данных геномных (экспрессионные и мутационные профили) и эпигеномных исследований (рис.1). В 16,4% случаев РЖ обнаруживаются гипергенные мутации [15,16].
Рисунок 1 | Генетические и эпигенетические характеристики гастроканцерогенеза. Опухолевая гетерогенность представляет собой существенное препятствие для выявления оптимальной таргетной терапии рака желудка (РЖ). Разрозненные данные о генетических и эпигенетических аберрациях не изменили традиционных терапевтических стратегий. Для реализации прецизионного подхода у пациентов с РЖ необходима молекулярная классификация, основанная на выделении ключевых путей патогенеза. Комплексная оценка молекулярного статуса опухоли и клиникопатологической картины – таким должен быть современный «золотой стандарт» ведения пациентов. MSI- микросателлитная нестабильность; CIN – хромосомная нестабильность; ЭБВ+ РЖ – Эпштейн-Барр позитивный рак желудка [2, 6, 8. 15, 24, 25].
Современные комплексные молекулярные классификации РЖ. Огромные массивы данных, полученные в ходе геномного секвенирования, требуют разработки эффективных методов интеграции в рутинную клиническую практику. Систематизация и выделение наиболее часто встречающихся паттернов РЖ позволит реализовать потенциал молекулярных исследований.
Таблица 1 | Наиболее масштабные исследования молекулярных сигнатур РЖ
| авторы | молекулярные подтипы | объем выборки | частота встречаемости, % |
| TCGA | EBV + | 295 | 8,81 |
| MSI высокий | 21,69 | ||
| GS | 19,66 | ||
| CIN | 49,83 | ||
| ACRG | MSS / TP53 + | 300 | 35,70 |
| MSS / TP53 – | 26,30 | ||
| MSS / EMT | 15,30 | ||
| MSI | 22,70 | ||
| Deng и др. | FGFR2 | 233 | 9,00 |
| KRAS | 9,00 | ||
| EGFR | 8,00 | ||
| ERBB2 | 7,00 | ||
| MET | 37,00 | ||
| Wong и др. | ТрТ | 49 | 36,73 |
| CpG | не представлены | ||
| TpCp [A / T] | не представлены | ||
| Kakiuchi и др. | RHOA + | 87 | 25,3 |
| RHOA – | 74,7 |
Примечания
1. Исследование The Cancer Genome Atlas (TCGA): Эпштейн-Барр-инфицированные опухоли (EBV+); опухоли с высоким уровнем микросателлитной нестабильности (microsatellite instability, MSI), геномно-стабильные опухоли (genomically stable, GS), хромосомно-нестабильные опухоли (chromosomal instability, CIN) (рис. 2) [17, 18].
2. Исследование The Asian Cancer Research Group (ACRG): на основе комплексных генетических характеристик РЖ ACRG проанализировали экспрессию гена в 300 образцах первичных опухолей желудка. Они выделили четыре молекулярных подтипа (рис. 2): опухоли с низким уровнем микросателлитной нестабильности (microsatellite stable, MSS) с/без мутаций tumor protein 53 (TP53), демонстрирующие эпителиально-мезенхимальную пластичность (epithelial-to-mesenchymal transition, EMT), опухоли с высоким уровнем MSI [20]. Опухоли MSS / EMT имеют самую высокую частоту рецидивов (63%) и неблагоприятный прогноз; подтип MSI рецидивирует реже (22%) и характеризуется самым благоприятным общим прогнозом; МSS/ТР53-положительные и МSS/ТР53-отрицательные подтипы имеют промежуточный прогноз и вероятность рецидивов. Таким образом, ACRG предлагает молекулярную классификацию, которая фокусируется на ассоциации между генетическим профилированием и клиническими исходами.
3. Deng и др. исследовали наиболее распространенные молекулярные мишени при РЖ: рецептор фактора роста фибробластов-2 (fibroblast growth factor receptor 2, FGFR2); гомолог вирусного онкогена саркомы крыс 2 Кирстен (Kirsten rat sarcoma viral oncogene homolog, KRAS); рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR); ERBB2 – ген, кодирующий human epidermal growth factor receptor 2 (HER2); ген, кодирующий рецептор фактора роста гепатоцитов (MET) [20].
4. Wong и др. определили три комбинации динуклеотидов, наиболее часто подверженные альтерации: thymine-phosphate-thyminе (TpT); cytosine-phosphate-guanine (CpG); thymine-phosphate-cytosine-phosphate (TpCp [A / T]) [6].
5. Kakiuchi и др. исследовали РЖ диффузного типа изменение экспрессии гена ras-гомологичной малой гуанозин-трифосфатазы (ras homolog family member A, RhoA) в образцах РЖ диффузного типа [12].
Наиболее валидными являются молекулярные классификации, предложенные Азиатской онкологической исследовательской группой (the Asia Cancer Research Group, ACRG) и проектом Центра Атлас генома рака (The Cancer Genome Atlas, TCGA) [21].
Поиск новых драйверных мутаций. Технологии геномного секвенирования нового поколения (next-generation sequencing, NGS) подтвердили ведущую роль мутаций TP53 и CDH1 (ген, кодирующий E-кадгерин) при РЖ, но в настоящее время наличие или отсутствие этих мутаций не изменяет стратегии лечения [22, 23].
Новые терапевтические мишени, обнаруженные методами NGS, значительно дополняют существующие представления о путях гастроканцерогенеза (рис.2). Основное внимание исследователей направлено на изучение механизмов ремоделирования хроматина, клеточной активности, модификации цитоскелета, феномену эпителиально-мезенхимальной пластичности [1, 24].
Терапевтическая стратегия у конкретного больного РЖ должна соответствовать требованием прецизионной медицины (рис. 3). Такой результат возможен при комплексном анализе фенотипических, геномных и эпигеномных характеристик, использовании новых доклинических моделей (тканевая инженерия опухолей) [20].
Рисунок 3 | Интегрированная стратегия прецизионной медицины для РЖ. Опухолевые образцы, полученные методом биопсии или циркулирующих опухолевых клеток, подвергаются клинико-гистопатологическому исследованию и геномному анализу NGS. Определяют геномные изменения – потенциальные мишени терапии. Формируют модель злокачественной опухоли с использованием технологий тканевой инженерии (ксенографты, органоиды). Эффективность и безопасность методов лечения исследуется в экспериментальных моделях. В итоге пациент получает оптимизированную таргетную терапию на основе этой интегрированной стратегии [19, 20, 24. 25].
Заключение
Геномика РЖ испытывает сейчас настоящую революцию благодаря развитию технологий NGS. Достижения в этой области привели к созданию нового подхода к классификации РЖ: помимо набора гистопатологических характеристик проводится анализ полного генома, а в перспективе также эпигенома, метаболома, протеома, транскриптома (мультиомиксный анализ). Это огромное количество информации определяет уникальный индивидуальный профиль опухоли. Для интерпретации данных секвенирования требуется разработка систем визуализации, позволяющих интегрировать гетерогенные данные. Однако истинная ценность молекулярных сигнатур определяется возможностями клинического применения. Например, в исследовании TCGA обнаружена сверхэкспрессия PD-1/PD-L1 (белок программируемой смерти клеток 1 типа и его лиганд) в клетках Эпштейн-Барр-позитивного РЖ. Антагонисты PD-L1 – потенциальные высокоточные таргетные препараты для таких пациентов[11]. Разработаны два моноклональных антитела PD-1: Opdivo (nivolumab) и Keytruda (pembrolizumab). Потенциальными мишенями являются рецепторы тирозиновых киназ, RAS сигнальные белки, МЕТ [25]. Новые стратегии терапии, модификация сигнальных путей, вовлеченных в канцерогенез у конкретного пациента, моделирование биологического поведения опухоли, прогнозирование результатов и выживаемости – таким представляется будущее прецизионной медицины. И фундамент новой парадигмы закладывается уже сегодня.
Источники:
1. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-years for 32 Cancer Groups, 1990 to 2015: A Systematic Analysis for the Global Burden of Disease Study/ C. Fitzmaurice [et al.]//JAMA Oncol.-2017.-Vol.3(4).-P.524–548.
2. Chen T. Emerging molecular classifications and therapeutic implications for gastric cancer/ T. Chen, X.Y. Xu, P.H. Zhou// Chin J Cancer.-2016.-Vol.35.-P.49-61.
3. Cristescu R. Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes// R. Cristescu, J. Lee, M. Nebozhyn// Nat. Med.- 2015. Vol.21.-P.449–456.
4. Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification/ P. Lauren// Acta Pathol. Microbiol. Scand.-1965.-Vol.64.-P.31-49.
5. Langner C. Precursors of gastric cancer: Dysplasia and adenoma/ C. Langner// Pathology.-2017.-Vol.38(2).-P.67-74.
6. Genomic landscape and genetic heterogeneity in gastric adenocarcinoma revealed by whole-genome sequencing/S.S. Wong [et al.]// Nat. Commun.- 2014.-Vol.5.-P.54-77.
7. Lauren classification and individualized chemotherapy in gastric cancer/ J.Ma [et al.]// Oncology Letters.- 2016.-Vol.11(5).-P.2959-2964.
8. Molecular classification and prediction in gastric cancer/L.Xiandong [et al.]//Computational and Structural Biotechnology Journal.-2015.-Vol. 13.-P.448-458.
9. Zhang W. TCGA divides gastric cancer into four molecular subtypes: implications for individualized therapeutics/ W. Zhang// Chin. J Cancer.-2014.- Vol.33(10).-Р.469–470.
10. McCracken K.W. Wnt/b-catenin promotes gastric fundus specification in mice and humans// K.W. McCracken, E. Aihara, B. Martin// Nature.- 2017.-Vol.541.-P.182–187.
11. Merker S.R.Gastrointestinal organoids: how they got it out// S.R. Merker, J. Weitz, D.E. Stange// Dev. Biol.- 2016.-Vol.420.-P.239–250.
12. Recurrent gain-of-function mutations of RHOA in diffuse-type gastric carcinoma/ M. Kakiuchi [et al.]//Nat. Genet.- 2014.-Vol.46.-P. 583-587.
13. A cohort study and meta-analysis between histopathological classification and prognosis of gastric carcinoma/L.Liu [et al.]//Anticancer Agents Med. Chem.- 2013.- Vol.13(2).-P.227-234. 14. Alterations of tumor-related genes do not exactly match the histopathological grade in gastric adenocarcinomas/ G.Y.Liu [et al.]//World J. Gastroenterol.- 2010.-Vol.16.-P.1129-1137.
15. Comprehensive molecular characterization of gastric adenocarcinoma/ A.J. Bass[et al.]// Nature.-2014.-Vol.513.-P.202-209.
16. Identification of molecular subtypes of gastric cancer with different responses to PI3-kinase inhibitors and 5-fluorouracil / Z. Lei [et al.]// Gastroenterology.-2013.-Vol.145.-P.554-565.
17. Epstein-Barr virus infection and gastric cancer: a systematic review/ X.Z. Chen [et al.]// Medicine (Baltimore).- 2015.-Vol.94(20).-P.788-792.18. Gastric Cancer Genomics: Advances and Future Directions/ W. Bryson [et al.]//Cellular and Molecular Gastroenterology and Hepatology.-2017.-Vol. 3.-P. 211 – 217.
19. Hidalgo M. Patient-derived xenograft models: an emerging platform for translational cancer research// M. Hidalgo, F. Amant, A.V. Biankin// Cancer Discov.-2014.-Vol.4.-P.998–1013.
20. A comprehensive survey of genomic alterations in gastric cancer reveals systematic patterns of molecular exclusivity and co-occurrence among distinct therapeutic targets/N. Deng [et al.]// Gut.- 2012.-Vol.61.-P.673-684.
21. Clinical Significance of Four Molecular Subtypes of Gastric Cancer Identified by The Cancer Genome Atlas Project/ B.H. Sohn [et al.]//Clin. Cancer Res.-2017.- Vol.23 (15).-P.4441-4449.
22. Hansford S. Hereditary diffuse gastric cancer syndrome: CDH1 mutations and beyond/ S.Hansford, P. Kaurah, H. Li-Chang//JAMA Oncol.-2015.-Vol.1.-P.23–32.
23. Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers/ R.S. Van der Post [et al.]//Journal of Medical Genetics.-2015.-Vol.52(6).-P.361-374.
24. Gene mutations in gastric cancer: a review of recent next-generation sequencing studies/Y. Lin [et al.]//Tumour Biol.-2015.-Vol.36(10).-Р.7385–7394.
25. Liu X. Gastric Cancer in the Era of Precision Medicine/ X. Liu, S.J. Meltzer//Cell Mol. Gastroenterol. Hepatol.-2017.-Vol.20, № 3(3).-P.348-358.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
