Послеоперационный панкреатит при раке желудка
К сожалению, нередко приходится встречаться с ситуациями, когда онкологический пациент обратился за помощью тогда, когда эффективное лечение его болезни уже невозможно. К счастью, встречаются ситуации, когда назначенное лечение, на эффективность которого трудно рассчитывать, даёт замечательный результат, позволяя впоследствии максимально «радикализировать» проводимое лечение, что благоприятно сказывается на продолжительности и качестве жизни пациента. Но сейчас я хочу рассказать об ещё одном варианте развития событий: когда картина, с которой обратился пациент, выглядит бесперспективно и логично, но внимательное её изучение позволяет увидеть черты благоприятного прогноза там, где все видели лишь отчаяние. Данный пример – это очередное доказательство того, что не следует схематично воспринимать клиническую ситуацию, а также всецело полагаться на заключения, которыми пациент располагает в момент обращения. Выражаем благодарность Андрею Львовичу Пылёву за представленный случай и образец внимательного отношения к пациенту.
Кстати, готовя описание этого клинического случая, мы обратили внимание на дату операции и приурочили его публикацию к своеобразному трёхлетнему юбилею этого важного события в жизни пациента.
Пациент А., 65 лет.
В начале 2016 года пациента начали беспокоить выраженные боли в эпигастрии, подъёмы температуры тела до 39°С. В связи с отсутствием устойчивого эффекта от симптоматической терапии пациент было инициировано обследование, в рамках которого была выполнена компьютерная томография, выявившая опухоль поджелудочной железы, врастающая в стенку желудка.
После выписки пациент обратился в медицинский центр в Москве, где при ЭГДС была выполнена биопсия из стенки желудка. По данным гистологического исследования была верифицирована умереннодифференцированная аденокарцинома.
В одной из ведущих специализирующихся на хирургии Московских клиник была выполнена эксплоративная лапаротомия. Интраоперационно была выявлена массивная опухоль поджелудочной железы, вовлекающая стенку желудка и, главное, магистральные сосуды, в связи с чем она была признана нерезектабельной.
Уже после пробной операции пациенту были выполнены КТ и УЗИ, по результатам которых был сформулирован диагноз «Рак поджелудочной железы с врастанием в магистральные сосуды, корень брыжейки, стенку желудка». Пациенту были обозначены самые мрачные перспективы и проведён 1 курс паллиативной химиотерапии гемцитабином.
Пациент обратился в Европейскую клинику в надежде на альтернативный взгляд на его клиническую ситуацию.
Первым делом обратило на себя внимание несоответствие выставленного диагноза (местнораспространённый рак поджелудочной железы), а также распространённости процесса и весьма удовлетворительного состояния пациента. Наличие верификации опухолевых изменений слизистой желудка также оставляло надежду на то, что выставленный пациенту диагноз не был корректен.
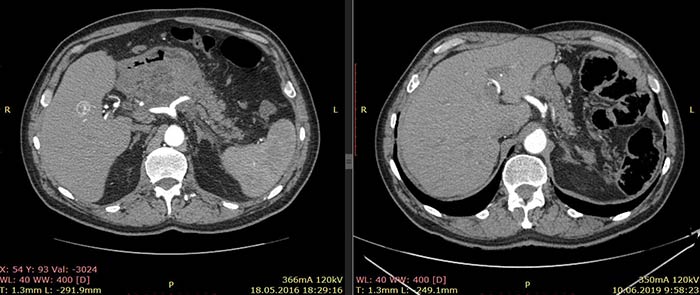
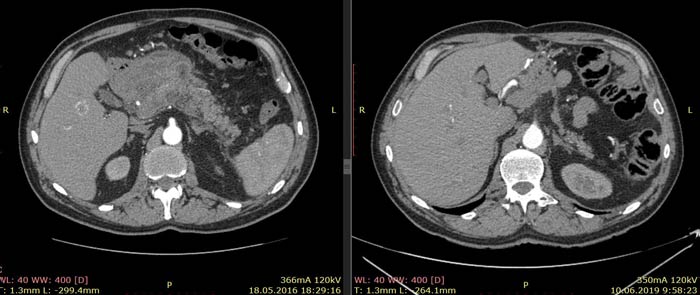
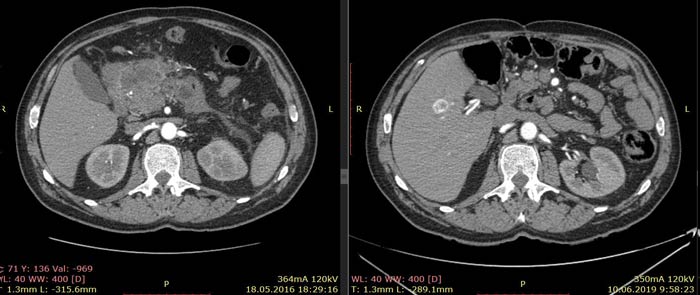
По данным КТ от 18.05.16 была описана опухоль тела и антрального отдела желудка с инвазией в тело поджелудочной железы без вовлечения магистральных артерий и вен, с лимфаденопатией по малой кривизне желудка (более вероятно, метастатической). Изменения в головке и теле поджелудочной железы расценены как псевдотуморозный панкреатит как исход панкреанекроза. Также была выявлена лимфаденопатия брыжейки тонкой кишки (более вероятно, реактивная).
Имеющиеся данные позволили нам изменить диагноз на «Рак желудка с распространением на поджелудочную железу», что, конечно, повлекло за собой пересмотр тактики лечения. С учётом отрицательного Her2-статуса опухоли пациенту было рекомендовано проведение неоадъювантной химиотерапии по схеме FLOT.
После окончания неоадъювантной химиотерапии для оценки распространённости процесса пациенту было предложено выполнить ПЭТ-КТ. Была выявлена метаболическая активность в стенке желудка на уровне его тела и в области перешейка поджелудочной железы. Парагастральная клетчатка уплотнена, лимфатические узлы в ней мелкие, метаболически неактивные.
13.11.16 пациенту была выполнена радикальная операция: гастрэктомия, спленэктомия, лимфаденэктомия, плоскостная резекция поджелудочной железы, удаление лимфатических узлов брыжейки тонкой кишки, образования на брюшине передней брюшной стенки, эзофаго-энтероанастомоз на выключенной по Ру петле тонкой кишки, энетеро-энтероанастомоз.
По данным гистологического исследования бы установлен диагноз «Рак желудка с распространением на поджелудочную железу, pT4bpN0M0R0»: тубулярная аденокарцинома.
Через 10 дней пациент был выписан с рекомендациями по проведению адъювантной химиотерапии по схеме FLOT.
В настоящее время пациент находится под динамическим наблюдением, регулярно приезжая в Европейскую клинику для прохождения контрольного обследования. В частности, по данным КТ от 10.06.19 в сравнении с данными от 17.12.18 уменьшение размеров поствоспалительной псевдокисты в области хвоста поджелудочной железы с 3,1 до 2,2 см, данные за наличие проявлений опухолевого процесса в очередной раз получены не были.
С момента выхода данного поста пациент ещё раз планово обратился в Европейскую клинику в декабре 2019 года для прохождения контрольного обследования. Мы с огромным удовольствием в очередной раз зафиксировали отсутствие признаков возобновления болезни и рекомендовали повторить контрольное обследование через 6 месяцев.
Примечание: из-за изменившейся после крупной операции анатомии соответствующие иллюстрации от 18.05.16 и 10.06.19 даны на уровнях соответствующих ветвей брюшного отдела аорты.
Ниже приведены результаты КТ: опухоль тела и антрального отдела желудка с инвазией в тело поджелудочной железы, псевдотуморозный панкреатит (слева) и состояние после гастрэктомии, без признаков наличия рецидива заболевания (справа).
Источник
Острый панкреатит как самостоятельное заболевание известен с 1889 г., когда R. Fitz впервые опубликовал данные о случае правильной его прижизненной диагностики (цит. по С.В. Лобачеву, 1953). В настоящее время он прочно занимает третье место среди острых хирургических заболеваний органов брюшной полости (Р.В. Вашетко, 2000; Э.В. Луцевич, 2001; Ю.А. Нестеренко, 2004; Э.И. Гальперин и соавт., 2006; В.С. Савельев, 2006).
Острый послеоперационный панкреатит (ОПП) является разновидностью этого заболевания, характеризующийся ранним появлением некротических и гнойных осложнений со стороны поджелудочной железы (ПЖ), брюшной полости и забрюшинного пространства (С.А. Дадвани, 2000; А.М. Шулутко, 2000; А.С. Ермолов, 2007; H.G. Beger, 2005).
Своевременный диагноз ОПП устанавливают только в 14,3-60,4% наблюдений (В.И. Филин, 2000; И.П. Томашук, 2002; А.Д. Толстой, 2005; П.С. Ветшев и соавт., 2008; R. Pezzilli, 2004; P.G. Lankisch, 2006). Оценка частоты острого послеоперационного панкреатита (ОПП) затруднена, т.к. одни хирурги учитывают только тяжелые формы, другие считают достаточным для этого отклонение от нормы лабораторных показателей – повышение уровня амилазы мочи и крови при отсутствии клинических проявлений. Кроме того, продолжительность послеоперационного периода в каждом конкретном случае тоже точно не определена (Б.А. Сотниченко, 1995). Поэтому частота развития ОПП после хирургических вмешательств на органах верхнего этажа брюшной полости колеблется в широких пределах от 0,08 до 100% (А.Л. Костюченко и соавт., 2000; Е.С. Катанов 2000, А.В. Татуров и соавт., 2006; В.В. Шабанов, 2007; P.A. Banks et al., 1995).
После паллиативных вмешательств на поджелудочной железе (ПЖ) у больных с травмой ПЖ ОПП развивается в 76,6% случаев, а после резекции ПЖ – в 6,9-40% [2,3]. Резекции желудка по поводу язвенной болезни осложняются ОПП у 7,9-31,4% больных [4, 6]. При радикальных вмешательствах по поводу рака желудка ОПП встречается у 1,8-21,8% больных [1, 3-5]. К этому приводит не только непосредственная травма поджелудочной железы, но и расширенная лимфаденэктомия, сопровождающая операции при раке желудка, что вызывает необходимость в проведении профилактики осложнений, особенно ОПП.
Летальность при возникновении ОПП колеблется от 19,5 до 80% и зависит от тяжести процесса. Госпитальная летальность при деструктивных формах ОПП варьирует в пределах 50-100% [В.А. Кубышкин, 2003; Б.С. Брискин, 2006; М.И. Филимонов, 2006; В.Ф. Зубрицкий, 2007; А.В. Пугаев, 2007; Ю.М. Стойко и соавт., 2008]. В связи с этим, одним из перспективных направлений в хирургической гастроэнтерологии является пред- и интраоперационная профилактика ОПП. В литературе существуют многочисленные подходы к профилактике ОПП, и этим вопросом занимается большое количество хирургов. Профилактика ОПП может осуществляться как хирургическими, так и медикаментозными путями.
В последние годы для профилактики и в комплексном лечении ОПП с высокой эффективностью широко применяются синтетические аналоги соматостатина (О.Э. Карпов и соавт., 2006; T. Foitzik, 2001; S. Connor, 2005). В настоящее время разработаны пролонгированные формы данных препаратов октреотид-депо, сандостатин-лар (Ю.В. Иванов, 2005; А.Н. Сафаров, 2006; Z. Bush, 2003). Оценка эффективности их применения в лечебном алгоритме может внести существенные коррективы в профилактику и лечение ОПП (И.И. Затевахин, 2002; Ю.В., Иванов 2005; A.B. Nathens, 2004).
Цель настоящего исследования – изучение влияния препаратов октреотида короткого и пролонгированного действия на частоту развития ОПП у пациентов после оперативных вмешательств при раке желудка, сопровождающихся расширенной лимфодиссекцией.
В исследование были включены 594 больных (360 мужчин и 234 женщины), оперированных по поводу рака желудка с 2004 по 2012 г. в Клинике Факультетской Хирургии ПМГМУ им. И.М. Сеченова и Отделении хирургии пищевода и желудка РНЦХ им. акад. Б.В. Петровского. Средний возраст составил 69±13 (от 27 до 85 лет). Преимущественно, опухоли локализовались в антральном отделе и теле желудка у 229 (38,5%) и 205 (34,5%) пациентов соответственно (табл. 1).
Практически у всех пациентов диагностирована аденокарцинома различной степени дифференцировки – 480 (80,8%) наблюдений, у остальных выявлен перстневидноклеточный – 110 (18,5%) и плоскоклеточный рак – 4 (0,67%).
С целью анализа эффективности профилактического применения аналогов соматостатина все больные были разделены на три репрезентативные группы. Формирование групп проводилось проспективно, методом «случай-контроль», по основным прогностическим критериям (пол, возраст, наличие сопутствующих заболеваний, стадия и распространенность опухолевого процесса). В результате проведенного анализа выявлена полная сопоставимость групп до начала лечения.
1-я группа (n=220) – с целью профилактики ОПП использовали октреотид производства ЗАО «Фарм-синтез» по схеме: 200 мг до операции, по 100 мг 3 раза в день после операции в течение 6 дней. Октреотид – синтетический аналог соматостатина. Подавляет повышенную секрецию гормона роста и пептидов, продуцируемых в гастроэнтеро-панкреатической эндокринной системе, и опосредовано снижает желудочную секрецию, нивелирует моторику ЖКТ и висцеральный кровоток. После его введения отмечают уменьшение возврата крови в портальную систему и понижение давления в воротной вене. Он оказывает цитопротективное действие на клетки паренхимы поджелудочной железы, печени и желудка. Этот препарат рекомендуют применять при остром панкреатите; для профилактики и лечения осложнений после операций на поджелудочной железе. Считают, что при его применении во время операции на поджелудочной железе снижается частота типичных послеоперационных осложнений: панкреатических свищей, абсцессов, сепсиса, послеоперационного острого панкреатита [4].
Профилактику ОПП во 2-й группе (n=98) проводили октреотидом-депо («Фарм-синтез»). Октреотид-депо 10 мг вводили за 7 дней до операции. Октреотид-депо – это длительно действующий аналог соматостатина, в отличие от препарата короткого действия период полувыведения октреотида-депо составляет 672 ч, а длительность эффекта – 28 сут. Максимальная концентрация достигается на 7-е сутки; при этом происходит максимальное ингибирование активности поджелудочной железы и поддержание этого состояния в раннем и позднем послеоперационном периодах. Обладая большинством эффектов соматостатина, «октреотид-депо» имеет более благоприятные фармакокинетические свойства, что расширяет возможности его клинического применения.
В 3-й группе (n=276) применяли 5-фторурацил (5-ФTУ) с даларгином и контрикалом по схеме: 5-фторурацил – 500 мг интраоперационно, по 500 мг в течение 3 дней после операции; даларгин – 5,0 мл интраоперационно и по 5,0 мл в течение 6 дней.
Производные пиримидина 5-фторурацила (5-ФТУ) и фторафура избирательно накапливаются в поджелудочной железе и угнетают синтез белков в ней. Поэтому их используют в качестве ингибитора ферментпродуцирующей активности панкреоцитов. Выраженный эффект подавления активности трипсина и амилазы крови наблюдается уже через 15 мин после введения 5-ФТУ в дозе 10-15 мг/кг МТ и лишь через месяц внешнесекреторная активность поджелудочной железы возвращается к норме. В паренхиме железы кумулирует 5-фторуксусная кислота, которая является прямым ингибитором активной липазы. Экспериментальные данные позволили рекомендовать 5-ФТУ для профилактики ОПП [6].
Антисекреторный препарат – даларгин угнетает желудочную секрецию, снижает активность ферментов поджелудочной железы (ПЖ), улучшает лимфоциркуляцию и микроциркуляцию, стимулирует лимфоток, в том числе в ПЖ [9].
Характер оперативных вмешательств: гастрэктомия и дистальная субтотальная резекция желудка были наиболее частыми операциями и составили 205 и 229 соответственно (табл. 2). Объем лимфодиссекции варьировал от Д2 и Д2,5 (340 и 209 больных соответственно) до лимфаденэктомии Д3 (45 наблюдений). Статистически значимых различий в объемах выполненных операций в сравниваемых группах выявлено не было.
Объем лимфодиссекции варьировал от Д2 и Д2,5 (340 и 209 больных соответственно) до лимфаденэктомии Д3 (45 наблюдений). Статистически значимых различий в объемах выполненных операций в сравниваемых группах выявлено не было.
Послеоперационный панкреатит диагностировали, используя методы лабораторной (активность амилазы мочи, крови и в жидкости, оттекающей по улавливающим дренажам брюшной полости, содержание трипсиногена-2 в моче) и инструментальной диагностики (УЗИ органов брюшной полости и КТ по показаниям). Диагностически значимым считали стойкий (не менее 2 дней подряд) или рецидивирующий подъем активности ферментов в крови, моче и/или перитонеальном экссудате не менее чем в 1,5 раза.
Инфузионное лечение, обезболивающие препараты, антибиотики, антикоагулянты все больные получали по одинаковой схеме.
Среднее количество отделяемого по дренажам из брюшной полости в 1-й группе – 255 мл, во 2-й группе – 240 мл; в 3-й группе – 280 мл; уровень панкреатической амилазы в нем выше нормы у 26,1%, 22%, 41,26% соответственно.
Показатели панкреатической амилазы крови в передах нормы наблюдали в 1-й группе у 68,8%, во 2-й группе – у 82%, в 3-й группе – у 53,4% пациентов.
Результаты клинического исследования показали, что в раннем послеоперационном периоде значительное и стойкое повышение уровня α-амилазы в сыворотке крови, мочи и в отделяемом из дренажей было зафиксировано в 3-й группе, и было в 2 два раза выше по сравнению с группой октреотида-депо и в 1,2 раза выше по сравнению с пациентами, которые получали терапию октреотидом короткого действия (см. рисунок). Рисунок 1. Общая динамика доли пациентов с повышенным уровнем амилазы в крови, моче и отделяемом по дренажам. По результатам анализа динамики амилазы крови внутри групп, можно заключить, что оба производных соматостатина показывают равно высокую эффективность. И все выявленные отличия между 1-й и 2-й группами не имеют статистической достоверности.
Рисунок 1. Общая динамика доли пациентов с повышенным уровнем амилазы в крови, моче и отделяемом по дренажам. По результатам анализа динамики амилазы крови внутри групп, можно заключить, что оба производных соматостатина показывают равно высокую эффективность. И все выявленные отличия между 1-й и 2-й группами не имеют статистической достоверности.
Динамика снижения уровня амилаземии у пациентов 2-й группы на фоне проводимой терапии более выражена, и нормализация этого показателя наступает быстрее, чем у пациентов 1-й и 3-й групп.
Следует отметить, что уровень α-амилазы в сыворотке крови, мочи и в отделяемом из дренажей зависели также от объема лимфодиссекции D2-D2.5 или D3. Учитывая травматизм забрюшинной лимфаденэктомии в объеме D3, показатели амилаземии и амилазурии были в 2,5 ниже при лимфаденэктомии D2-D2.5.
При анализе частоты и тяжести послеоперационных осложнений (табл. 3) отмечено, что в группе октреотида-депо ОПП был на самом низком уровне и составил 3,06%, в группе октреотида – 16,8%, в контрольной группе – 22,4% (p<0,01). Деструктивные формы ОПП мы наблюдали во 2-й и 3-й группах у 1 (1,02%) и 3 (1,08%) больных соответственно. При использовании октреотида короткого действия панкреонекроза не наблюдали.
отмечено, что в группе октреотида-депо ОПП был на самом низком уровне и составил 3,06%, в группе октреотида – 16,8%, в контрольной группе – 22,4% (p<0,01). Деструктивные формы ОПП мы наблюдали во 2-й и 3-й группах у 1 (1,02%) и 3 (1,08%) больных соответственно. При использовании октреотида короткого действия панкреонекроза не наблюдали.
Другие послеоперационные осложнения связаны с развитием ОПП, т.к. внутрибрюшные абсцессы были чаще в 1-й и 3-й группах – 1 (0,45%) и 6 (2,17%) соответственно. Доля несостоятельности анастомозов сохранялась низкой во всех анализируемых выборках: 1-я группа – 0,9%, 2-я группа – 1,02%, 3-я группа – 2,89% (p<0,01), и в большинстве наблюдений (8) были связаны с ОПП. Внутрибрюшные абсцессы при необходимости дренировали под контролем УЗИ и рентгенотелевидения, проводили проточное и фракционное промывание дренажей, стоящих в полости абсцесса.
Реактивный плеврит наблюдался у 5 (2,27%) больных 1-й и у 11 (3,98%) пациентов 3-й группы, во 2-й группе этот показатель был минимален – 1 (1,02%) (p>0,05).
Выраженный послеоперационный парез кишечника, который потребовал бы каких-либо вмешательств, ни в одном случае зафиксирован не был, несмотря на непосредственное угнетение моторики желудочно-кишечного тракта препаратами соматостатина.
Летальность в 1-й группе составила 0,9%, во 2-й – 1,02% и в 3-й – 1,8%. Практически все летальные исходы были связаны с развитием гнойно-септических осложнений на фоне несостоятельности анастомозов вследствие панкреонекроза. У одного пациента 1-й группы и у одного из 3-й группы смерть наступила от развития острой сердечно-сосудистой недостаточности.
Средняя длительность пребывания в стационаре была наименьшей в группе «октреотида-депо» – 22±10 к/д, в 1-й группе – 24±10 к/д и самой длительной в 3-й группе – 35±10 к/д.
В ходе проведенного анализа можно заключить, что синтетические аналоги соматостатина являются эффективными препаратами выбора для медикаментозной профилактики ОПП после радикальных операций при раке желудка с расширенной лимфаденэктомией и могут быть использованы в режиме монотерапии.
Применение аналогов соматостатина в комплексной послеоперационной профилактике осложнений, приводит к их достоверному уменьшению, прежде всего частоты острого деструктивного панкреатита. Крайне перспективным является использование аналогов соматостатина длительного действия, в том числе октреотид-депо в дозировке 10 мг.
Однако детальная отработка схем профилактики и возможности использования этих препаратов при травматичных операциях на поджелудочной железе требуют дальнейшего изучения.
Источник

Операции при раке поджелудочной железы могут выполняться с целью радикального удаления опухоли, либо паллиативно, для уменьшения объема опухолевой ткани и/или устранения жизнеугрожающих осложнений.
В большинстве случаев злокачественные опухоли поджелудочной железы диагностируются на поздних стадиях, поэтому радикальная операция возможна приблизительно у 15% пациентов. Стоит отметить, что такие операции – длительные, объемные, травматичные и сопряжены с высоким риском осложнений как в интраоперационном, так и послеоперационном периодах. Вместе с тем это единственный метод радикального лечения, который позволяет продлить жизнь пациента на несколько лет.
При выборе тактики лечения врачи опираются на критерии операбельности рака поджелудочной железы, разработанные NCCN, с помощью которых определяются резектабельные, нерезектабельные и пограничные опухоли.
Состояние резектабельности опухоли ПЖ:
- опухоль не затрагивает верхнюю брыжеечную артерию;
- чревный ствол и печеночная артерия интактны;
- верхняя брыжеечная вена и воротная вена проходимы.
Состояние пограничной операбельности опухоли:
- верхняя брыжеечная вена инфильтрирована опухолью менее, чем на половину своей окружности, либо имеется контакт опухолевых очагов со стенкой сосуда;
- инфильтрирован футляр печеночной артерии на небольшом протяжении. В этом случае оперирующий врач должен быть готов к резекции сосуда с последующим проведением пластики;
- возможно вовлечение в опухолевый процесс короткого сегмента верхней брыжеечной вены или воротной вены, при этом стенка сосуда выше и ниже места инфильтрации должна быть абсолютно неизмененной.
Признаки нерезектабельности опухоли:
- окружность верхней брыжеечной артерии инфильтрирована более чем наполовину;
- опухолевая инфильтрация чревного ствола, при которой нет возможностей выполнения реконструктивной пластики после удаления пораженного сегмента сосуда;
- полная окклюзия верхней брыжеечной вены и/или воротной вены.
Следует учитывать, что погранично-операбельные опухоли — это весьма условный термин. Раньше считалось, что вовлечение в процесс сосудистых образований является препятствием для оперативного лечения. Современные возможности хирургии позволяют удалить опухоль и восстановить целостность сосудистых коллекторов с использованием аллогенных трансплантатов. Возможность проведения таких операций зависит от навыков оперирующего хирурга и технической оснащенности клиники, поэтому пациентов с признаками пограничной резектабельности рекомендуется направлять в лечебные учреждения более высокого уровня для получения второго экспертного мнения и повторной оценки резектабельности.
Боль при злокачественных опухолях ПЖ
Боль при раке поджелудочной железы носит сильный, мучительный характер и локализуется в верхней части живота. Она может отдавать в позвоночник, грудину, сердце, лопатки и руки. В ряде случаев именно боль является первым признаком заболевания, в других ситуациях она присоединяется позже — при прогрессировании злокачественного процесса.
При установленном диагнозе для облегчения симптома пациент должен принимать анальгетики, в том числе наркотического ряда. Как правило, используется морфин. Предпочтение отдается препаратам для перорального применения. Но при развитии обструкции пищеварительного тракта или нарушении акта глотания возможно применение пластыря или инъекций.
Для пациентов, которые не переносят анальгетики или при снижении их эффективности можно применять блокаду солнечного сплетения (сеть нервных окончаний, располагающихся позади поджелудочной железы). Анальгезирующие препараты вводятся либо чрескожно под контролем КТ, либо под контролем эндоскопического УЗИ через стенку желудка. Эффект достигается у 50-90% больных и держится от 1 месяца до года.
Виды оперативного вмешательства при злокачественных опухолях поджелудочной железы
К радикальным операциям при раке поджелудочной железы относят:
- Гастропанкреатодуоденальная резекция — частичное удаление желудка, поджелудочной железы и двенадцатиперстной кишки с сохранением пилоруса или без него. Такие вмешательства применяются при локализации опухоли в головке ПЖ.
- Панкреатэктомия — полное удаление поджелудочной железы. Такие вмешательства используются при локализации опухоли в теле и хвосте железы. Для хирурга технически полное удаление железы несколько проще, чем частичное, но после таких вмешательств пациент должен будет пожизненно принимать гормональнозаместительную и ферментозаместительную терапию.
- Дистальная панкреатэктомия — производится резекция тела и хвоста поджелудочной железы, а также удаление селезенки. Такие операции выполняются крайне редко ввиду особенностей распространения опухолевого процесса.
Радикальные операции могут выполняться как открытым лапаротомическим доступом, так и с помощью эндоскопического оборудования через несколько маленьких проколов. Но и в том и другом случае необходимо удаление лимфатических узлов в стандартном объеме.
Следует отметить, что решение о возможности проведения радикального вмешательства может приниматься непосредственно во время операции, после ревизии тканей, куда чаще всего распространяется опухоль. Не исключены случаи, когда при обнаружении признаков нерезектабельности врач прекращает первоначально запланированную операцию и приступает к паллиативным вмешательствам.
К паллиативным операциям относят:
- операции внутреннего желчеотведения — эндоскопическое стентирование желчных протоков, наложение билиодигестивных анастомозов и др.;
- операции, направленные на организацию наружного дренирования желчных путей — чрезкожное чреспеченочное дренирование.
Такие операции не избавляют пациента от опухоли, но устраняют или предотвращают развитие таких жизнеугрожающих состояний, как механическая желтуха или непроходимость органов ЖКТ. Дело в том, что опухоли поджелудочной железы могут врастать или сдавливать желчные протоки, приводя к застою желчи и, как следствие, к критическому повышению уровня билирубина. Если вовремя не купировать такое состояние, оно может привести к гибели пациента. После паллиативных операций продолжительность жизни пациентов в среднем составляет около 8 месяцев.
Радикальные операции при опухолях головки поджелудочной железы
При раке, локализующемся в головке поджелудочной железы, проводят гастропанкреатодуоденальную резекцию. Во время операции удаляют 2/3 желудка, желчный пузырь, головку ПЖ, двенадцатиперстную кишку и лимфатические узлы. Только таким образом можно резецировать все поврежденные раком ткани и пути его метастазирования.
В ряде случаев желудок не трогают. Этот вариант хирургического вмешательства называется операцией по Лонгмире/Траверсо. При ней также возможно сохранение пилоруса — сфинктера привратника желудка. Такая техника позволяет предотвратить развитие ряда проблем с пищеварением. Заключительным этапом выполняют восстановление непрерывности пищеварительного тракта и выведение протоков пищеварительных желез в желудок или кишечник с помощью анастомозов.
Возможными проблемами после таких вмешательств могут быть:
- несостоятельность анастомозов из-за их разрушения едким соком поджелудочной железы;
- нехватка пищеварительных ферментов;
- резекция желудка может привести к миграции кишечных бактерий в вышележащие отделы ЖКТ и развитию инфекционных осложнений;
- развитие демпинг-синдрома — поступление в тонкий кишечник необработанной пищи. При этом возникают приступы учащенного сердцебиения, скачок артериального давления, диарея, снижение массы тела вплоть до кахексии. В тяжелых случаях приступы тахикардии могут длиться несколько часов.
Тотальная панкреатэктомия
Полное удаление поджелудочной железы производится при злокачественном поражении всех тканей органа в случаях, когда опухоль не выходит за его пределы. Во время операции удаляется вся железа, селезенка, часть желудка, желчный пузырь, и часть тонкой кишки.
После операции пациента ожидают глубокие нарушения в области углеводного обмена и пищеварения. Чтобы скорректировать эти состояния необходимо пожизненно принимать инсулин и пищеварительные ферменты.
Последствия операций на поджелудочной железе
Еще несколько десятков лет назад хирурги предпочитали не связываться с поджелудочной железой вообще, поскольку ее повреждение во время операции могло стать фатальным для больного. Сегодня, с развитием хирургических технологий и фармацевтики возможна жизнь даже после тотальной панкреатэктомии.
В целом последствия после онкологических операций на поджелудочной железе наблюдаются всегда, так как происходит полная или частичная утрата органа, ответственного как за углеводный обмен, так и за секрецию пищеварительных ферментов. Чем больший объем железистой ткани удален, тем сильнее будут выражены нарушения. Чтобы компенсировать эти последствия, необходимо придерживаться ряда правил:
- строгая диета;
- соблюдение режима питания;
- прием ферментозамещающих препаратов;
- коррекция углеводного обмена с помощью инъекций инсулина.
Диета и режим питания
Первые несколько дней после операции пероральное питание невозможно, поэтому пациент должен получать поддерживающие растворы внутривенно. Затем все же следует отдавать предпочтение кормлению через рот.
Пищу следует принимать маленькими порциями 5-6 раз в день. Она должна быть приготовлена на пару или протушена. В целом рекомендуется отдавать предпочтение блюдам, богатым белками и, по возможности, отказаться от «легких» углеводов и жиров.
Необходимо исключить ряд продуктов, например, свежий хлеб и выпечку, все виды приправ, острых блюд, копчености, маринады, шоколад, сладости, молочные продукты. Более подробные рекомендации даст лечащий врач с учетом особенностей конкретного клинического случая.
Во время каждого приема пищи необходимо принимать ферментные добавки. Это могут быть альфа-амилаза, фестал, креон, микразим и др. Они нормализуют переваривание пищи и устраняют чувство тяжести, тошноту и явления диспепсии.
Терапия инсулином
При полном удалении поджелудочной железы для нормализации углеводного обмена необходима терапия синтетическим инсулином, аналогично тому, как это делают больные с сахарным диабетом. Подбор дозы и режим введения препарата определяется врачом-эндокринологом индивидуально для каждого пациента.
Восстановление
Операции при злокачественных опухолях поджелудочной железы обширны и травматичны, поэтому пациент будет нуждаться в уходе. В первые 2-3 дня он будет находиться в условиях реанимации. Если все в порядке, пациента переводят в профильное отделение.
Для того чтобы избежать таких осложнений как тромбозы, спайки и пневмонии, рекомендуется ранняя мобилизация, если нет противопоказаний. В первое время пациенту достаточно просто переворачиваться в постели и выполнять специальные упражнения и дыхательную гимнастику. Чтобы снизить нагрузку на область швов, их можно придерживать подушкой. После того как больной окрепнет, ему разрешается сидеть и вставать с постели для коротких прогулок. На этом этапе уже можно использовать послеоперационный бандаж. В среднем, сроки госпитализации варьируют в пределах 2-4 недель, в зависимости от способа проведения операции (лапароскопически и лапаротомически).
После резекции поджелудочной железы все пациенты теряют вес. Чтобы пищеварительная система приспособилась к новым условиям работы, необходимо 1,5–3 месяца. Весь этот период нужно строго следовать рекомендациям касательно диеты. При полном удалении железы этих ограничений придется придерживаться пожизненно, также, как и принимать гормонозаместительные и ферментные препараты.
Прогноз
Радикальная операция при злокачественной опухоли поджелудочной железы – это единственный способ полностью устранить рак. Если возникают рецидивы, принимается решение о выборе дальнейшей тактики лечения. Это может быть химиотерапия, радиотерапия, гормональное лечение и другие методы.
У врачей Европейской клиники имеется большой опыт лечения пациентов, страдающих раком поджелудочной железы. Несмотря на достаточно агрессивную форму заболевания, пациентам с диагнозом «рак поджелудочной железы» помочь можно всегда. В одних случаях удается достичь увеличения продолжительности жизни, в других — снятия болевого синдрома и улучшения качества жизни.
Источник
