Ранний рак желудка эндоскопическая классификация
Эндоскопическая диагностика наиболее информативна, поскольку позволяет получить биопсийный материал для подтверждения диагноза.
Эндоскопическая классификация раннего рака желудка
I тип – выступающий (protruded)
II тип – поверхностный (superficial):
- приподнятый (elevated)
- плоский (flat)
- углублённый (depressed)
III тип – вогнутый (excavated)
- К выступающему раку относят экзофитные полиповидные новообразования размером 0,5-2 см с невыраженной или короткой ножкой, широким основанием, плоской или втянутой верхушкой.
- Приподнятый рак представляет собой образование, возвышающееся на 3-5 мм над поверхностью слизистой оболочки в виде плато, имеющего участки некрозов и углублений.
- Плоский рак имеет вид уплотнённого участка слизистой оболочки округлой формы, лишённого типичного рельефа слизистой оболочки.
- Углублённый рак визуально характеризуется чётко очерченными плоскими эрозивными полями с неровными краями, располагающимися несколько ниже уровня слизистой оболочки. В очаге поражения отсутствует блеск, характерный для нормальной слизистой оболочки.
- Вогнутый рак представляет собой дефект слизистой оболочки диаметром до 1-3 см с неоднородно утолщёнными ригидными краями, выступающими над поверхностью слизистой оболочки, и неровным дном, глубина которого может быть более 5 мм.
Визуальная диагностика ранних форм рака желудка и их дифференциальная диагностика с доброкачественными полипами и язвами очень трудны, в связи с этим необходимо применять дополнительные методы исследования (биопсия, хромогастроскопия). Хромогастроскопия – выявление раннего рака желудка путём изучения собственной и тетрациклиновой люминесценции опухоли, определяемой при гастроскопии и в биоптатах. В зоне злокачественной опухоли и при наличии элементов рака в биоптатах снижается интенсивность собственного свечения и повышается свечение после введения тетрациклина ввиду способности опухолевых клеток накапливать его. Окончательный диагноз раннего рака желудка возможен только на основании данных морфологического исследования материала множественных биопсий.
Эндоскопическая классификация развитых форм рака желудка
Полиповидный рак желудка
Неинфильтративная раковая язва (блюдцеобразный рак желудка)
Инфильтративная раковая язва
Диффузный инфильтративный рак желудка
- Полиповидный рак – чётко отграниченная экзофитно растущая опухоль с широким основанием, гладкой, бугристой или узловатой поверхностью.
- Неинфильтративная раковая язва (блюдцеобразный рак) имеет вид большой глубокой язвы диаметром 2-4 см, чётко отграниченной от окружающей ткани, с неровными краями.
- Инфильтративная раковая язва имеет нечетко выраженные края, которые в некоторых местах отсутствуют, и её бугристое дно непосредственно переходит в окружающую слизистую оболочку. Складки слизистой оболочки вокруг язвы ригидные, широкие, невысокие, не расправляются при нагнетании воздуха, перистальтические волны не прослеживаются. Граница между краями язвы и окружающей слизистой оболочкой отсутствует. Нередко контуры язвенного кратера трудно очертить из-за наличия грубого рельефа дна. В таких случаях инфильтративная раковая язва представляется в виде нескольких не резко отграниченных друг от друга дефектов, располагающихся на канцерозном массиве. Инфильтративная раковая язва приводит к грубой деформации желудка.
- Диффузный инфильтративный рак. Характеризуется подслизистым ростом опухоли, что затрудняет её эндоскопическую диагностику. При вовлечении в процесс слизистой оболочки развивается типичная эндоскопическая картина “злокачественного” рельефа: поражённый участок несколько выбухает, складки неподвижные, “застывшие”, плохо расправляются при нагнетании воздуха, снижена или отсутствует перистальтика, слизистая оболочка “безжизненная”, имеет преимущественно серый цвет.
В случаях присоединения инфекции и развития воспаления инфильтративный рак визуально трудно дифференцировать от локальной формы поверхностного гастрита и доброкачественных изъязвлений, особенно в проксимальном отделе желудка. Об этом следует всегда помнить и производить биопсию всех острых изъязвлений. Гистологическое и цитологическое исследование биопсийного материала имеет решающее значение в установлении окончательного диагноза рака желудка и его морфологического типа.
Peд. A. Mapтынoв
Читайте также в этом разделе:
- Рентгенография рака желудка
- УЗИ рака желудка
- Вся информация по этому вопросу
Источник
Полный текст статьи:
Терминология
Ранний рак это аденокарцинома ограниченная слизистой или подслизистым слоем вне зависимости от инвазии в лимфатические узлы [3]. Само понятие раннего рака, как и общий подход к градации неопластических изменений эпителия ЖКТ у Японской и Европейско-Американской школ не вполне совпадают. Японский ученные практически не употребляют термин “дисплазия”, а Европейские патологи склонны не рассматривать в качестве рака рак “in situ” и “рак слизистой”. Различия в подходе вызывают и различия тактики, так поставив диагноз раннего рака Вы немедленно должны начать лечение, пациент с дисплазией может оставаться под наблюдением. В Японии существует следующая градация неопластических изменений эпителия (каждой из которых соответствует определенный тактических подход) [6]:
- Норма или доброкачественные изменения слизистой без признаков атипии.
- Атипия в результате регенераторных изменений.
- Пограничные изменения, которые нельзя однозначно классифицировать как аденоматозные, регенераторные или неопластические.
- Патологические очаги, напоминающие карциному.
- Патологические очаги несомненно являющиеся карциномой, вне зависимости от глубины инвазии.
В 1-2 группах не показано даже наблюдение, 3 группа требует эндоскопического контроля или эндоскопического удаления, 4 – эндоскопической резекции слизистой, а 5 эндоскопической резекции или хирургической операции с соблюдением всех принципов онкохирургии. Как отмечалось выше в Европе и США интроэпителиальный рак, не говоря уже о раке “in situ” рассматриваются как доброкачественные изменения с соответствующими клиническими подходами. Такой подход они объясняют отсутствием данных подтверждающих прогрессию таких изменений в инвазивный рак.
Так называемая Венская классификация раннего рака [5] была предложена для снятия противоречий между Японскими и Европейскими патологами по данному вопросу. Переработанная Венская классификация выглядит следующим образом [1]:
- Без интроэпителиальной неоплазии.
- Сомнительная интроэпителиальная неоплазия.
Интроэпителиальная неоплазия низкой степени.
- Аденома/дисплазия.
Неоплазия высокой степени без инвазии (интроэпителиальная или внутрислизистая).
- Аденома/дисплазия.
- Неинвазивная карцинома.
- Подозрение на инвазивную карциному.
- Внутрислизистая карцинома (инвазия в собственную пластинку).
- Карцинома с подслизистой инвазией.
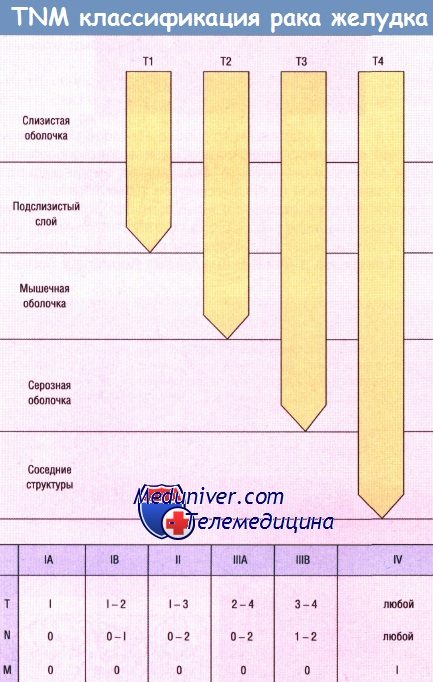
Рассматривая ранний рак с позиции классификации по TNM то карциноме без инвазии в собственную пластинку слизистой соответствует Tis, при инвазии в собственную пластинку Т1-m, при подслизистой инвазии T1-sm.
Естественное течение раннего рака желудка
Эта проблема так же активно дискутируется. Японские авторы считают доказанным прогрессирование раннего рака в его зрелые формы [8]. В Европе и США его считают “псевдо раком” редко прогрессирующим в его “реальные” формы [2,7]. Считается, что ранний рак в своем развитии проходит несколько стадий изъязвления и затем повторного рубцевания, более того, этот процесс может привести к самоизлечению. В качестве подтверждения своего мнения Японские ученные опубликовали в 2000 году в журнале Gut исследование естественного развития раннего рака у 56 пациентов с эндоскопически диагностированным (и подтвержденным при биопсии) ранним раком желудка не получивших радикальное лечение, по различным причинам, по крайней мере в течение 6 месяцев после установки диагноза (средняя длительность наблюдения составляла 39 месяцев) [9]. В сроки наблюдения у 20 больных рак оставался на ранней стадии, в то время как у 36 (64,3 %) он прогрессировал в “зрелые” формы. Средняя длительность сохранения ранней стадии рака составляла 44 месяца. И не смотря на некоторые проблемы связанные с дизайном данного исследования оно носит весьма убедительный характер.
Интересная работа на туже тему было опубликовано итальянскими учеными [4]. Было прослежено естественное течение 118 случаев неинвазивной неоплазии желудка, в том числе 90 – низкой степени, 16 – высокой степени и 3-х случаев подозрительных на инвазивную карциному). Среднее время наблюдения составило 52 месяца. При неоплазии низкой степени ее регрессия наблюдалась у 53,3 % пациентов, у 31,1 % больных морфологических изменений в сроки наблюдения отмечено не было, в 6,6 % случаев она прогрессировала в неоплазию высокой степени. У 8,8% больных развился рак желудка. В случае неоплазии высокой степени (Японские авторы сказали бы рак слизистой или интроэпителиальный рак) у 11 пациентов (68,7 %) развился в рак желудка в течение 13-72 месяцев. Таким образом, было продемонстрировано, что риск развития рака зависит от степени неоплазии.
По нашему мнению эти два независимые исследование свидетельствуют о безусловном развитии ранних неинвазивных форм рака в его “зрелые” формы и требует отношения к ним как к ранней стадии злокачественной патологии, а не как к “предраковым изменениям слизистой”.
Источник
1. Колобаев И.В. Выбор объема лимфаденэктомии при раннем раке желудка. [дис. … канд. мед. наук]. [Москва]; 2009. 105. 2. Туркин И.Н., Давыдов М.И. Что определяет объем лимфодиссекции при раннем раке желудка? Сибирский онкологический журнал. 2013; 2: 12–17. 3. Скоропад В.Ю., Бердов Б.А. Ранний (pT1) рак желудка: клиникоморфологические характеристики и результаты хирургического лечения. Анналы хирургии. 2003; 4: 30–36. 4. Lambert R. Participants in the Paris Workshop. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest. Endosc. 2003; 58 (6 Suppl): S3–43.
5. Hatta W., Gotoda T., Oyama T., Kawata N., Takahashi A., Yoshifuku Y., Hoteya S., Nakagawa M., Hirano M., Esaki M., Matsuda M., Ohnita K., Yamanouchi K., Yoshida M., Dohi O., Takada J., Tanaka K., Yamada S., Tsuji T., Ito H., Hayashi Y., Nakaya N., Nakamura T., Shimosegawa T. A Scoring System to Stratify Curability after Endoscopic Submucosal Dissection for Early Gastric Cancer: “eCura system”. Am J Gastroenterol. 2017 Jun; 112 (6): 874–881. doi: 10.1038/ajg.2017.95. 6. Gotoda T., Yanagisawa A., Sasako M., Ono H., Nakanishi Y., Shimoda T., Kato Y. Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer. 2000 Dec; 3 (4): 219–225. 7. Isozaki H., Okajima K., Ichiinona T., Fujii K., Nomura E., Izumi N., Ohyama T. Distant lymph node metastasis of early gastric cancer. Surg. Today. 1997; 27 (7): 600–605. . Abe S., Oda I., Nakajima T., Suzuki H., Nonaka S., Yoshinaga S., Sekine S., Taniguchi H., Kushima R., Iwasa S., Saito Y., Katai H. A case of local recurrence and distant metastasis following curative endoscopic submucosal dissection of early gastric cancer. Gastric Cancer. 2015; 18 (1): 188–192. doi: 10.1007/s10120-014-0341-7. 9. Han S., Hsu A., Wassef W.Y. An update in the endoscopic management of gastric cancer. Curr Opin Gastroenterol. 2016; 32 (6): 492–500. 10. Cesaretti M., Zarzavadjian L.E., Bian A. In vivo medical imaging technologies: new possibility in diagnosis of gastric cancer. Minerva Chir. 2016; 71 (4): 270–277. 11. Sumiyama K. Past and current trends in endoscopic diagnosis for early stage gastric cancer in Japan. Gastric Cancer. 2017; 20 (S1): 20–27. doi: 10.1007/s10120-016-0659-4. 12. Murakami T., Iwanami E., Yasui A., Watanabe H., Chai S. The newest problems in the diagnosis of early stomach cancer. Rinsho Geka. 1962 May; 17: 321–30. 13. Yoshimori M. The natural history of early gastric cancer. Jpn. J. Clin. Oncol. 1989; 19 (2): 89–93. 14. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2014 (ver. 4). Gastric Cancer. 2017 Jan; 20 (1): 1–19. doi: 10.1007/s10120-016-0622-4. 15. Ajani J.A., D’Amico T.A., Almhanna K., Bentrem D.J., Chao J., Das P., Denlinger C.S., Fanta P., Farjah F., Fuchs C.S., Gerdes H., Gibson M., Glasgow R.E., Hayman J.A., Hochwald S., Hofstetter W.L., Ilson D.H., Jaroszewski D., Johung K.L., Keswani R.N., Kleinberg L.R., Korn W.M., Leong S., Linn C., Lockhart A.C., Ly Q.P., Mulcahy M.F., Orringer M.B., Perry K.A., Poultsides G.A., Scott W.J., Strong V.E., Washington M.K., Weksler B., Willett C.G., Wright C.D., Zelman D., McMillian N., Sundar H. Gastric cancer, version 3.2016, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2016; 14 (10): 1286–1312. 16. Tanabe S., Hirabayashi S., Oda I., Ono H., Nashimoto A., Isobe Y., Nunobe S. Gastric cancer treated by endoscopic submucosal dissection or endoscopic mucosal resection in Japan from 2004 through 2006: JGCA nationwide registry conducted in 2013. Gastric Cancer. 2017 Feb 15. doi: 10.1007/s10120-017-0699-4. 17. Barreto S.G., Windsor J.A. Redefining early gastric cancer. Surg Endosc. 2016 Jan; 30 (1): 24–37. doi: 10.1007/s00464-015-4184-z. 18. Петерсон Б.Е., Чиссов В.И., Авдеев Г.И. Ранняя онкологическая патология. Медицина. 1985; 320. 19. Endoscopic Classification Review Group. Update on the paris classification of superficial neoplastic lesions in the digestive tract. Endoscopy. 2005; 37 (6): 570–578. 20. Lee J.H., Min Y.W., Lee J.H., Kim E.R., Lee H., Min B.H., Kim J.J., Jang K.T., Kim K.M., Park C.K. Diagnostic group classifications of gastric neoplasms by endoscopic resection criteria before and after treatment: real-world experience. Surg Endosc. 2016 Sep; 30 (9): 3987–93. doi: 10.1007/s00464-015-4710-z. 21. Gotoda T., Iwasaki M., Kusano C., Seewald S., Oda I. Endoscopic resection of early gastric cancer treated by guideline and expanded National Cancer Centre criteria. Br J Surg. 2010 Jun; 97 (6): 868–71. doi: 10.1002/bjs.7033. 22. Hasuike N., Ono H., Boku N., Mizusawa J., Takizawa K., Fukuda H., Oda I., Doyama H., Kaneko K., Hori S., Iishi H., Kurokawa Y., Muto M., Gastrointestinal Endoscopy Group of Japan Clinical Oncology Group (JCOG-GIESG). A non-randomized confirmatory trial of an expanded indication for endoscopic submucosal dissection for intestinal-type gastric cancer (cT1a): the Japan Clinical Oncology Group study (JCOG0607). Gastric Cancer. 2017 Feb 21. doi: 10.1007/s10120-017-0704-y. 23. Kim Y.H., Kim J.H., Kim H., Kim H., Lee Y.C., Lee S.K., Shin S.K., Park J.C., Chung H.S., Park J.J., Youn Y.H., Park H., Noh S.H., Choi S.H. Is the recent WHO histological classification for gastric cancer helpful for application to endoscopic resection? Gastric Cancer. 2016 Jul; 19 (3): 869–75. doi: 10.1007/s10120-015-0538-4. 24. Lee I.S., Lee S., Park Y.S., Gong C.S., Yook J.H., Kim B.S. Applicability of endoscopic submucosal dissection for undifferentiated early gastric cancer: Mixed histology of poorly differentiated adenocarcinoma and signet ring cell carcinoma is a worse predictive factor of nodal metastasis. Surg Oncol. 2017 Mar; 26 (1): 8–12. doi: 10.1016/j.suronc.2016.12.001 25. Imamura T., Komatsu S., Ichikawa D., Kawaguchi T., Kosuga T., Okamoto K., Konishi H., Shiozaki A., Fujiwara H., Otsuji E. Early signet ring cell carcinoma of the stomach is related to favorable prognosis and low incidence of lymph node metastasis. J Surg Oncol. 2016 Oct; 114 (5): 607–612. doi: 10.1002/jso.24377. 26. Tan D., Lauwers G. Gastric Cancer. Lippincott Williams & Wilkins. 2011; 348. 27. Farinati F., Rugge M., Di Mario F., Valiante F., Baffa R. Early and advanced gastric cancer in the follow-up of moderate and severe gastric dysplasia patients. A prospective study. I.G.G.E.D.–Interdisciplinary Group on Gastric Epithelial Dysplasia. Endoscopy. 1993 May; 25 (4): 261–4. 28. Ryu D.G., Choi C.W., Kang D.H., Kim H.W., Park S.B., Kim S.J., Nam H.S. Clinical outcomes of endoscopic submucosa dissection for highgrade dysplasia from endoscopic forceps biopsy. Gastric Cancer. 2017 Jul; 20 (4): 671–678. doi: 10.1007/s10120-016-0665-6. 29. Fertitta A.M., Comin U., Terruzzi V., Minoli G., Zambelli A., Cannatelli G., Bodini P., Bertoli G., Negri R., Brunati S. Clinical significance of gastric dysplasia: a multicenter follow-up study. Gastrointestinal Endoscopic Pathology Study Group. Endoscopy. 1993; 25 (4): 265–268. 30. Borchardt H., Borrmann R., Christeller E., Dietrich A., Fischer W., Gierke E.V., Mayer E. Verdauungsschlauch: Dritter Teil. Softcover reprint of the original 1st ed. 1929 edition. Berlin: Springer. 2012; 1076. 31. Kajitani T. The general rules for the gastric cancer study in surgery and pathology. Jpn J Surg. 1981 Mar; 11 (2): 127–39. 32. Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma: 3rd English edition. Gastric Cancer. 2011 Jun; 14 (2): 101–12. doi: 10.1007/s10120-011-0041-5. 33. Ohta H., Noguchi Y., Takagi K., Nishi M., Kajitani T., Kato Y. Early gastric carcinoma with special reference to macroscopic classification. Cancer. 1987 Sep 1; 60 (5): 1099–106. 34. Ohara Y., Toshikuni N., Matsueda K., Mouri H., Yamamoto H. The superficial elevated and depressed lesion type is an independent factor associated with non-curative endoscopic submucosal dissection for early gastric cancer. Surg Endosc. 2016; 30 (11): 4880–88. 35. Abe S., Oda I., Shimazu T., Kinjo T., Tada K., Sakamoto T., Kusano C., Gotoda T. Depth-predicting score for differentiated early gastric cancer. Gastric Cancer. 2011; 14 (1): 35–40. 36. Nakamura T., Yao T., Kakeji Y., Anai H., Morita M., Oda Y., Maehara Y. Depressed type of intramucosal differentiated-type gastric cancer has high cell proliferation and reduced apoptosis compared with the elevated type. Gastric Cancer. 2013 Jan; 16 (1): 94–9. doi: 10.1007/ s10120-012-0152-7. 37. Собин Л.Х. TNM. Классификация злокачественных опухолей. Логосфера, 2011; 22. 38. Антонович В.Б. Рентгенодиагностика заболеваний пищевода, жедудка, кишечника. М.: Медицина, 1987; 400. 39. Аруин Л.И., Григорьев П.Я., Исаков В.А., Яковенко Э.П. Хронический гастрит. Амстердам, 1993; 362. 40. Park K., Jang G., Baek S., Song H. Usefulness of combined PET/ CT to assess regional lymph node involvement in gastric cancer. Tumori. 2014 Mar-Apr; 100 (2): 201–6. doi: 10.1700/1491.16415. 41. Park Y.M., Cho E., Kang H.Y., Kim J.M. The effectiveness and safety of endoscopic submucosal dissection compared with endoscopic mucosal resection for early gastric cancer: a systematic review and metaanalysis. Surg Endosc. 2011 Aug; 25 (8): 2666–77. doi: 10.1007/ s00464-011-1627-z. 42. Park J.H., Lee S.H., Park J.M., Park C.S., Park K.S., Kim E.S., Cho K.B. Prediction of the indication criteria for endoscopic resection of early gastric cancer. World J Gastroenterol. 2015 Oct 21; 21 (39): 11160–7. doi: 10.3748/wjg.v21.i39.11160. 43. Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification. Acta Pathol Microbiol Scand. 1965; 64: 31–49. 44. Chen Y.C., Fang W.L., Wang R.F., Liu C.A., Yang M.H., Lo S.S., Wu C.W., Li A.F., Shyr Y.M., Huang K.H. Clinicopathological Variation of Lauren Classification in Gastric Cancer. Pathol Oncol Res. 2016 Jan; 22 (1): 197–202. doi: 10.1007/s12253-015-9996-6. 45. Bosman F.T., Carneiro F., Hruban R.H., Theise N.D. WHO classification of tumours of the digestive system. World Health Organization, Lyon: IARC Press, 2010; 417. 46. Lewin K.J., Appelmen H.D. Morphological variants of gastric adenocarcinoma. Tumors Esophagus Stomach. Armed Forces Inst. Pathol. Wash. DC. 1996; 313–317. 47. Everett S.M., Axon A.T.R. Early gastric cancer in Europe. Gut. 1997; 41 (2): 142–150. 48. Ming S.C. Gastric carcinoma. A pathobiological classification. Cancer. 1977; 39 (6): 2475–2485. 49. Nagayo T. Microscopical cancer of the stomach a study on histogenesis of gastric carcinoma. Int J Cancer. 1975 Jul 15; 16 (1): 52–60. 50. Grundmann E., Schlake W. Histological classification of gastric cancer from initial to advanced stages. Pathol Res Pract. 1982; 173 (3): 260–74. 51. Kodama Y., Inokuchi K., Soejima K., Matsusaka T., Okamura T. Growth patterns and prognosis in early gastric carcinoma. Superficially spreading and penetrating growth types. Cancer. 1983 Jan 15; 51 (2): 320–6. 52. Goseki N., Takizawa T., Koike M. Differences in the mode of the extension of gastric cancer classified by histological type: new histological classification of gastric carcinoma. Gut. 1992 May; 33 (5): 606–12. 53. Hamilton S.R., Aaltonen L.A. WHO classification of tumours. Pathology and genetics of tumours of the digestive system. Geneva WHO, IARC Press, Lyon 2000; 103–19. 54. Fang C., Shi J., Sun Q., Gold J.S., Xu G.F., Liu W.J., Zou X.P., Huang Q. Risk factors of lymph node metastasis in early gastric carcinomas diagnosed by WHO criteria in 379 Chinese patients. J Dig Dis. 2016; 17 (8): 526–537.
Источник
Классификация рака желудка. Ранний рак желудка.

В 1926 году Borrmann предложил макроскопическую классификацию рака желудка. Она очень удобна, поэтому до сих пор используется не только патологоанатомами, но и рентгенологами, гастроэнтерологами и хирургами. Классификация Borrmann следующая:
I. Полиповидный рак. II. Язвенный рак с приподнятыми краями. III. Язвенный рак с частичной или полной инфильтрацией его краев. IV. Частичный или полный инфильтративный рак (linitis plastica).
Японские ученые рассматривают классификацию рака желудка Borrmann как передовую. В последние годы к данной классификации добавлено 5 новых групп, отражающих ранние стадии рака.
Можно сделать заключение, что I и II группы классификации Borrmann соответствуют микроскопическому кишечному типу, согласно классификации Lauren, и экспансивному типу — согласно классификации Ming. Вместе с тем, группы III и IV отражают диффузный тип по классификации Lauren и инфильтративный тип — по классификации Ming.
Как будет показано далее, хотя гистологическая характеристика рака желудка важна для установления прогноза заболевания, она не входит в классификацию по TNM. В 1965 г. Lauren предложил гистологическую классификацию, выделив даа типа рака желудка — (а) кишечный и (b) диффузный. Кишечный тип формируется железистыми структурами, имеет сходство с раком толстой кишки и обычно сосуществует с метаплазией слизистой оболочки желудка по кишечному типу. Опухоли кишечного типа имеют лучший прогноз, чем опухоли диффузного типа. Они чаще встречаются в странах с повышенной заболеваемостью раком желудка — Японии, Чили, Коста-Рике и Колумбии.
В странах, где заболеваемость раком желудка в последние годы снизилась, например, в США и некоторых европейских странах, наблюдается уменьшение количества опухолей кишечного типа. Диффузный тип по классификации Lauren образуется отдельными клетками или группами клеток с незначительной воспалительной реакцией без формирования железистых структур. Рак диффузного типа является более злокачественным, может распространяться на весь желудок, как при linitis plastica (скирр).
При этом типе рака, отличие от кишечного типа, значительно чаще поражаются лимфатические узлы желудка.
В 1977 г. Ming также предложил гистологическую классификацию рака желудка, несколько похожую на классификацию Lauren. Ming разделил раковые опухоли на даа типа: (а) экспансивный и (b) инфильтративный. Экспансивный рак образуется связанными между собой группами клеток, вызывающими образование узлов, которые смещают нормальные структуры. Рак инфильтративного типа характеризуется наличием очагов клеточной инфильтрации, плохо связанных между собой. Кишечный тип по классификации Lauren похож на экспансивный классификации Ming, и оба типа имеют лучший прогноз, чем диффузный или инфильтративный типы.
Кишечный и экспансивный типы в основном образуют полиповидную опухоль с изъязвлением или без такового (группы I и II по макроскопической классификации Borrmann). Диффузный и инфильтративный типы пенетрпруют стенку желудка, образуя ограниченные или распространенные инфильтраты, которые соответствуют группам III и IV макроскопической классификации Borrmann.
В 1962 г. Японское обшество эндоскопистов и гастроэнтерологов разработало и предложило макроскопическую классификацию раннего рака желудка. Возникновение этой классификации обусловлено необходимостью диагностики рака желудка на ранних стадиях для более эффективного использования хирургического лечения.
Общество эндоскопистов определило ранний рак как поражение, ограниченное слизистой оболочкой и подслизистым слоем, без его дальнейшего распространения и без вовлечения в процесс лимфатических узлов. В Японии ранний рак желудка диагностируется в 30—40% случаев. В странах Запада ранний рак желудка выявляется в 10% случаев, а то и реже. В недавней публикации Wanebo и соавт., в которой представлен анализ 19000 случаев рака желудка по данным различных медипинских учреждений. ранний рак был диагностирован в 17% случаев, что является необычайно высоким показателем для Европы и США.
В Японии у больных, оперированных по поводу ранних форм рака, 5-летняя выживаемость составляет 80-90%. В Европе и США 5-летняя выживаемость составляет 50—60%. В Японии частота выявления пораженных лимфатических узлов при раннем раке желудка составляет от 5 до 20%. Чаще вовлекаются лимфатические узлы группы N, хотя встречается и поражение лимфатических узлов группы N2.
Ранний рак желудка обычно бывает бессимптомным. Когда появляются симптомы, они легкие и неспецифичные, за исключением язвенного рака, при котором возможны периодические боли или кровотечения. Некоторые авторы считают, что термин «ранний рак желудка» не является правильным, и что более правильно называть эту опухоль «поверхностным раком». В 1939 году Rene Gutmann, Bertrand и Peristiany в своей книге «Le Cancer de L’estomac au Debut» постоянно использовали термин «поверхностный рак», хотя вто время единственным доступным методом диагностики было рентгенологическое исследование. Stout из США при описании этого типа рака также использовал термин «поверхностный рак».
– Также рекомендуем “Международная классификация рака желудка. Лимфатическая система желудка.”
Оглавление темы “Лечение рака желудка. Операции при раке желудка.”:
1. Классификация рака желудка. Ранний рак желудка.
2. Международная классификация рака желудка. Лимфатическая система желудка.
3. Объем резекции желудка. Стадия опухоли желудка и объем резекции.
4. Распространенность рака желудка. Определение объема поражения при раке желудка.
5. Радикальная субтотальная резекция желудка. Техника субтотальной резекции желудка.
6. Создание анастомоза при субтотальной резекции желудка. Методика анастомозирования культи желудка.
7. Тотальная радикальная гастрэктомия. Ключевые моменты тотальной гастрэктомии.
8. Восстановление пищеварительного тракта после гастрэктомии. Эзофагоеюностомия.
9. Эзофагоеюностомия по Roux-en-Yc использованием ручных швов. Техника эзофагоеюностомии после резекции желудка.
10. Терминолатеральный эзофагоеюноанастомоз. Техника наложения терминального эзофагоеюноанастомоза.
Источник
