Ранний рак желудка это понятие

Классификация рака желудка. Ранний рак желудка.
В 1926 году Borrmann предложил макроскопическую классификацию рака желудка. Она очень удобна, поэтому до сих пор используется не только патологоанатомами, но и рентгенологами, гастроэнтерологами и хирургами. Классификация Borrmann следующая:
I. Полиповидный рак. II. Язвенный рак с приподнятыми краями. III. Язвенный рак с частичной или полной инфильтрацией его краев. IV. Частичный или полный инфильтративный рак (linitis plastica).
Японские ученые рассматривают классификацию рака желудка Borrmann как передовую. В последние годы к данной классификации добавлено 5 новых групп, отражающих ранние стадии рака.
Можно сделать заключение, что I и II группы классификации Borrmann соответствуют микроскопическому кишечному типу, согласно классификации Lauren, и экспансивному типу — согласно классификации Ming. Вместе с тем, группы III и IV отражают диффузный тип по классификации Lauren и инфильтративный тип — по классификации Ming.
Как будет показано далее, хотя гистологическая характеристика рака желудка важна для установления прогноза заболевания, она не входит в классификацию по TNM. В 1965 г. Lauren предложил гистологическую классификацию, выделив даа типа рака желудка — (а) кишечный и (b) диффузный. Кишечный тип формируется железистыми структурами, имеет сходство с раком толстой кишки и обычно сосуществует с метаплазией слизистой оболочки желудка по кишечному типу. Опухоли кишечного типа имеют лучший прогноз, чем опухоли диффузного типа. Они чаще встречаются в странах с повышенной заболеваемостью раком желудка — Японии, Чили, Коста-Рике и Колумбии.
В странах, где заболеваемость раком желудка в последние годы снизилась, например, в США и некоторых европейских странах, наблюдается уменьшение количества опухолей кишечного типа. Диффузный тип по классификации Lauren образуется отдельными клетками или группами клеток с незначительной воспалительной реакцией без формирования железистых структур. Рак диффузного типа является более злокачественным, может распространяться на весь желудок, как при linitis plastica (скирр).
При этом типе рака, отличие от кишечного типа, значительно чаще поражаются лимфатические узлы желудка.
В 1977 г. Ming также предложил гистологическую классификацию рака желудка, несколько похожую на классификацию Lauren. Ming разделил раковые опухоли на даа типа: (а) экспансивный и (b) инфильтративный. Экспансивный рак образуется связанными между собой группами клеток, вызывающими образование узлов, которые смещают нормальные структуры. Рак инфильтративного типа характеризуется наличием очагов клеточной инфильтрации, плохо связанных между собой. Кишечный тип по классификации Lauren похож на экспансивный классификации Ming, и оба типа имеют лучший прогноз, чем диффузный или инфильтративный типы.
Кишечный и экспансивный типы в основном образуют полиповидную опухоль с изъязвлением или без такового (группы I и II по макроскопической классификации Borrmann). Диффузный и инфильтративный типы пенетрпруют стенку желудка, образуя ограниченные или распространенные инфильтраты, которые соответствуют группам III и IV макроскопической классификации Borrmann.
В 1962 г. Японское обшество эндоскопистов и гастроэнтерологов разработало и предложило макроскопическую классификацию раннего рака желудка. Возникновение этой классификации обусловлено необходимостью диагностики рака желудка на ранних стадиях для более эффективного использования хирургического лечения.
Общество эндоскопистов определило ранний рак как поражение, ограниченное слизистой оболочкой и подслизистым слоем, без его дальнейшего распространения и без вовлечения в процесс лимфатических узлов. В Японии ранний рак желудка диагностируется в 30—40% случаев. В странах Запада ранний рак желудка выявляется в 10% случаев, а то и реже. В недавней публикации Wanebo и соавт., в которой представлен анализ 19000 случаев рака желудка по данным различных медипинских учреждений. ранний рак был диагностирован в 17% случаев, что является необычайно высоким показателем для Европы и США.
В Японии у больных, оперированных по поводу ранних форм рака, 5-летняя выживаемость составляет 80-90%. В Европе и США 5-летняя выживаемость составляет 50—60%. В Японии частота выявления пораженных лимфатических узлов при раннем раке желудка составляет от 5 до 20%. Чаще вовлекаются лимфатические узлы группы N, хотя встречается и поражение лимфатических узлов группы N2.
Ранний рак желудка обычно бывает бессимптомным. Когда появляются симптомы, они легкие и неспецифичные, за исключением язвенного рака, при котором возможны периодические боли или кровотечения. Некоторые авторы считают, что термин «ранний рак желудка» не является правильным, и что более правильно называть эту опухоль «поверхностным раком». В 1939 году Rene Gutmann, Bertrand и Peristiany в своей книге «Le Cancer de L’estomac au Debut» постоянно использовали термин «поверхностный рак», хотя вто время единственным доступным методом диагностики было рентгенологическое исследование. Stout из США при описании этого типа рака также использовал термин «поверхностный рак».
– Также рекомендуем “Международная классификация рака желудка. Лимфатическая система желудка.”
Оглавление темы “Лечение рака желудка. Операции при раке желудка.”:
1. Классификация рака желудка. Ранний рак желудка.
2. Международная классификация рака желудка. Лимфатическая система желудка.
3. Объем резекции желудка. Стадия опухоли желудка и объем резекции.
4. Распространенность рака желудка. Определение объема поражения при раке желудка.
5. Радикальная субтотальная резекция желудка. Техника субтотальной резекции желудка.
6. Создание анастомоза при субтотальной резекции желудка. Методика анастомозирования культи желудка.
7. Тотальная радикальная гастрэктомия. Ключевые моменты тотальной гастрэктомии.
8. Восстановление пищеварительного тракта после гастрэктомии. Эзофагоеюностомия.
9. Эзофагоеюностомия по Roux-en-Yc использованием ручных швов. Техника эзофагоеюностомии после резекции желудка.
10. Терминолатеральный эзофагоеюноанастомоз. Техника наложения терминального эзофагоеюноанастомоза.
Источник
Известно, что большинство онкологических больных выявляется только после достижения опухолью массы в 1 г (30 удвоений — 109 клеток) и приблизительно размеров в 1 см.
Инвазивная опухоль такого диаметра обнаруживается визуально, пальпаторно, рентгенологически и эндоскопически.
Хотя вероятность метастазирования еще сравнительно невелика, ориентироваться только на размер опухоли нельзя.
Опухоль диаметром и до 1 см может иногда давать регионарные и отдаленные метастазы (до 12% наблюдений), тогда как при больших 1 см размерах этот показатель достигает 60-70%.
Помимо размеров, большое значение имеют такие биологические особенности, как локализация, гистологический вариант и степень дифференцировки, скорость и форма роста. При учете всех этих факторов прогноза можно выделить особую форму онкологической патологии — ранний рак, который может быть излечен с наибольшей долей вероятности.
Общие сведения о ранней онкологической патологии
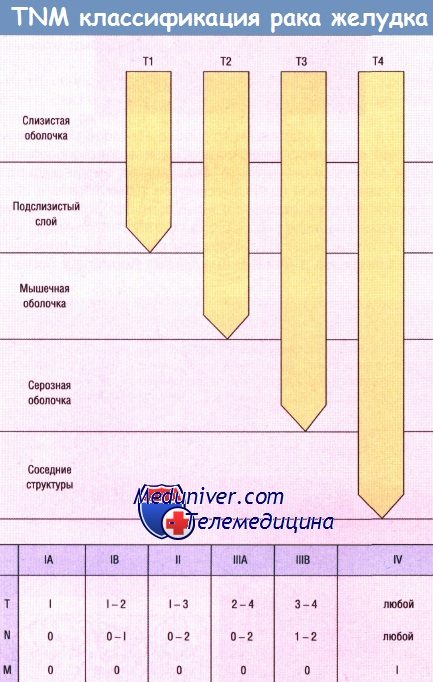
Термин «ранний рак» (early carcinoma) впервые предложен в Японии (1962) для рака желудка. Позднее были сформулированы основные критерии раннего рака любой локализации. В основном, это высокодифференцированная опухоль в пределах Т1, чаще с экзофитной формой роста, без регионарных и отдаленных метастазов, то есть это рак не выходящий за пределы слизистой, эпидермиса кожи, или другой ткани, на которой он возник.
Практически опухоль не должна выходить за рамки T1N0M0. Введение в клиническую практику термина «ранний рак» — это не дань терминологии, а возможность повышения эффективности радикального лечения и выживаемости больных при широком использовании органосохраняющих операций и адъювантного химиолучевого лечения.
Ранний рак — понятие клинико-морфологическое, основанное на тщательном изучении операционных данных и удаленного препарата. Точная характеристика раннего рака зависит от пораженного органа, но главный признак при раннем раке — ограничение опухоли пределами слизистой оболочки.
Для некоторых локализаций (слизистая губ и полости рта, пищевода, гортани, бронхов, шейки матки и др.) ранним раком является карцинома in situ. Для рака внутренних органов, выстланных железистым эпителием (желудок, кишечник, эндометрий) и паренхиматозных органов (молочная, щитовидная, предстательная железа и др.) понятие «ранний рак» может быть несколько шире и не совпадать с понятием «карцинома in situ» в силу особенностей архитектоники слизистых оболочек этих органов.
В принципе ранним раком можно было бы назвать I стадию заболевания — опухоль в пределах паренхимы органа без метастазов. Однако в связи с отсутствием единообразия в биологическом поведении новообразований различных локализаций, а также в различии возможностей диагностики, термин «ранний рак» должен уточняться в каждой конкретной ситуации. В одном случае это может быть только carcinoma in situ, в другом — минимальный или малый рак без метастазов, в третьем — T1N0M0.
Малый рак. В последние годы в практической онкологии в категории Т1 инвазивного рака выделена группа опухолей, носящая название «малый рак». Термин «малый» (small) встречается в литературе при ранней диагностике рака молочной и щитовидной желез, других органов и используются для обозначения небольшой по размерам опухоли, независимо от метастазирования.
Очевидно, что понятие «малый» рак отражает только размеры или объем опухоли и не является тождественным понятию «ранний» рак. Малый рак — это инвазивный рак, наименьшая опухоль (чаще 1 см в диаметре), уверенно определяемая клиническими методами исследования.
Биологическая агрессивность опухоли, метастазирование в расчет не принимаются. Хотя вероятность метастазирования в регионарные лимфатические узлы при уменьшении размеров первичного очага снижается, при малом раке она все же достигает 10-20%.
Термин же «ранний» предполагает определенный этап малигнизации, когда опухоль локализована, отсутствуют метастазы и можно с большой достоверностью предсказать благоприятный исход радикального лечения. Таким образом, инвазивный рак может считаться малым, но при этом не быть ранним (имеются метастазы).
Так, например, карцинома in situ желудка, являющаяся примером раннего рака, может занимать площадь до 10-12 см в диаметре; метастазы, как правило, отсутствуют, отдаленные результаты лечения самые благоприятные.
С другой стороны, очень маленький по размерам рак желудка может обладать инвазивными свойствами и являться источником обширных метастазов (лимфо- и гематогенных). 5-летняя выживаемость после радикального лечения раннего рака составляет 95%, а малого рака с поражением лимфатических узлов — менее 78%.
Опыт лечения «малого рака» невелик, однако в литературе уже идут дискуссии об изменении тактики лечения подобных опухолей, выборе объема операции, профилактической лимфаденэктомии и дополнительных методах специального лечения.
Особенности диагностики ранней онкологической патологии
В настоящее время, к сожалению, реалии в онкологии таковы, что у 2/3 больных уже к началу лечения опухоль распространена за пределы первичного очага, но метастазы еще клинически не проявляются. Поэтому необходимость совершенствования мероприятий по увеличению выявляемости форм раннего рака среди впервые зарегистрированных онкозаболеваний очевидна, а своевременная их диагностика — вполне решаемая задача.
Это утверждение базируется на ряде положений. Во-первых, длительность биологического развития большинства новообразований максимальна в пределах I стадии, пока рак локализован и чем меньше размеры опухоли, тем медленнее прогрессия.
Это дает время для проведения диагностических мероприятий. Во-вторых, большинство существующих предраковых состояний и бессимптомный рак можно обнаружить доступными современными методами диагностики или соответствующими программами скрининга, участвовать в которых население психологически, вероятно, уже подготовлено.
В-третьих, в стране имеется достаточно квалифицированных специалистов и современной аппаратуры для проведения диагностических исследований. Очевидно также, что принципы диагностики для каждой нозологической формы рака будут иметь свои методологические особенности. В данном разделе излагаются общие подходы.
Для выявления I фазы ранней онкологической патологии — предболезни — онкологический скрининг еще мало разработан, а часто и невозможен. На сегодняшний день с определенной долей вероятности предположить эту стадию можно путем выявления факторов риска.
Предрак можно обнаружить на основании клинической симптоматики и подтвердить морфологическими методами. Цитологическое изучение смывов, отпечатков, мазков, пунктатов помогают установить степень дисплазии. При сомнениях в диагнозе показана биопсия для гистологического исследования.
Для выявления раннего рака в гастроэнтерологии, бронхологии используются высокоинформативные методы эндоскопической визуализации очагов малых размеров (0,5-1 см) с прицельным забором материала для цито- и гистологического исследований Высокой разрешающей способности достигли методы диагностики раннего рака молочной железы, шейки и тела матки, щитовидной железы и других локализаций.
Благодаря широкому использованию морфологических методов, ошибки при дифференциальной диагностике раннего рака встречаются редко, хотя распознать его значительно труднее, чем распространенные его формы.
Поэтому на сегодняшний день совершенно не допустимо популярное ранее динамическое наблюдение при небольших размерах первично выявленного подозрительного очага. Он должен быть исследован морфологически независимо от его размеров и чем раньше, тем лучше.
Значительную роль в диагностике раннего рака играют социальные факторы воспитания. Симптомы заболевания нередко проявляются на этапе не только раннего рака, но и предрака. Поэтому санитарно-просветительная работа среди населения — обязательный и важный компонент в организации своевременной диагностики новообразований.
И хотя психология людей меняется довольно медленно, но они должны быть осведомлены о том, при каких симптомах необходимо срочно обращаться к врачу, иметь представления о ранних этапах малигнизации и уверенность в возможности предотвращения рака.
И хотя преимущества скрининга достаточно очевидны, тем не менее, правильная оценка индивидуальных особенностей пациента в каждом конкретном случае, диагностика раннего рака на приеме у врача еще долго будут стоять на повестке дня, поскольку онкологически грамотный врач — тоже проблема воспитания.
Принципы лечения ранней онкологической патологии
При прединвазивном раке (carcinoma in situ) методом выбора в лечении должно быть удаление опухоли. При этом могут быть варианты в виде ее локального иссечения, электрокоагуляции, криодеструкции, обработки лазером. Но всегда должна быть полная уверенность в диагнозе, которую может дать только эксцизионная биопсия. Поэтому этот метод одновременной и диагностики, и печения должен применяться как можно шире.
При доказанном микроинвазивном раке применяется стандартный обьем хирургического лечения. Адъювантная лучевая или химиогормонотерапия не проводятся, поскольку 5-летняя выживаемость высока и без применения дополнительных воздействий.
Вопрос об органосохраняющих (секторальные, сегментарные и клиновидные резекции) хирургических вмешательствах должен решаться индивидуально. В основном, они применяются только в случае противопоказаний к радикальному хирургическому лечению.
Однако органосохраняющие операции обязательно дополняются облучением или химиогомонотерапией. В целом, практика показывает, что в настоящее время преобладает тенденция суживать объем хирургических операций. Более подробно лечение различных форм ранней онкологической патологии конкретных локализаций излагаются в соответствующих руководствах по частной онкологии.
Подводя итог данного раздела, нужно признать, что проблемы классификации, диагностики и лечения ранней онкологической патологии в настоящее время — решающее направление в совершенствовании общемедицинской и онкологической служб, которое позволит существенно снизить смертность от злокачественных новообразований.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Опубликовал Константин Моканов
Источник
РАННИЙ РАК ЖЕЛУДКА (рТ1): ФАКТОРЫ ПРОГНОЗА,
ЗАКОНОМЕРНОСТИ ЛИМФОГЕННОГО МЕТАСТАЗИРОВАНИЯ, РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
В.Ю. Скоропад, Б.А. Бердов
Медицинский Радиологический Научный Центр РАМН, Обнинск
Определение раннего рака желудка было впервые дано Японским обществом гастроэнтерологической эндоскопии в 1962 г. К нему были отнесены опухоли, ограниченные пределами слизистого или подслизистого слоев стенки желудка вне зависимости от наличия метастазов в регионарные лимфатические узлы. Основаниями для выделения раннего рака желудка (рТ1) в противовес местно-распространенному (рТ2-4) явились полученные японскими исследователями исключительно благоприятные отдаленные результаты хирургического лечения этой категории больных. Концепция «раннего рака желудка» существует в неизменном виде уже более 40 лет и поддерживается большинством исследователей. В то же время, ряд авторов предлагает свою трактовку понятия раннего рака желудка, суживающую данную категорию больных за счет ограничений по глубине инвазии, размеру опухолевого поражения и наличию метастазов в регионарные лимфатические узлы.
Отдаленные результаты хирургического лечения раннего рака желудка, по данным различных авторов, варьируют весьма широко: 5-летняя выживаемость колеблется от 64% до 100%, 10-летняя выживаемость – от 62% до 98%. Причины столь значительных различий связаны, в первую очередь, с неоднородностью групп, то есть различным в каждой авторской серии соотношением больных в зависимости от глубины опухолевой инвазии, состояния регионарных лимфатических узлов и других клинико-морфологических факторов. Насколько часто встречается ранний рак желудка и является ли эта проблема действительно актуальной? Если в 50–80-е годы ХХ века в США, Австралии и Европейских странах доля раннего рака желудка среди радикально оперированных больных измерялась несколькими процентами, то к началу ХХI века она вплотную приблизилась или даже превысила 20%.
Частота метастазирования в лимфатические узлы при раннем раке желудка варьирует весьма широко – от 5,5% до 43%, но по данным абсолютного большинства авторов находится в пределах 10-20% . Это означает, что более чем у 80% больных объем операции – гастрэктомия и субтотальная резекция желудка со стандартной либо расширенной лимфаденэктомией – превышает достаточный с точки зрения достижения радикальности. У больных ранним раком желудка без метастазов в регионарные лимфатические узлы адекватным лечением может быть выполнение органосберегающих операций либо эндоскопических вмешательств.
Пристальное внимание к концепции раннего рака желудка связано также с попыткой достижения второй важнейшей цели лечения онкологических больных – более высокого качества жизни. В связи с этим выбор адекватного метода лечения является предметом активной дискуссии в мировой литературе.
Мы располагаем опытом хирургического лечения 920 больных раком желудка, среди них у 149 (16,2%) больных опухоль была ограниченна пределами слизистого или подслизистого слоев стенки желудка (Т1 в соответствии с 5-ым изданием классификации TNM и 2-ым английским изданием Японской классификации рака желудка).
Гастрэктомия была выполнена у 23 (15%) больных, дистальная субтотальная резекция желудка – у 98 (66%) больных, проксимальная субтотальная резекция желудка – у 3 (2%) больных. Во всех эти случаях единым блоком с желудком удалялись оба сальника, а также клетчатка вдоль левой желудочной артерии. У 21 (14%) больного была выполнена дистальная резекция желудка с неполным удалением перигастральных лимфатических узлов. Такой объем оперативного вмешательства использовали при наличии небольшого размера поверхностных опухолей пилорического отдела желудка.
Мы наблюдали статистически значимый рост частоты раннего рака желудка среди радикально оперированных больных с 7,7% в 70-е годы до 22,2% в 90-е годы и в настоящее время. Среди 149 больных было 87 мужчин и 62 женщины. Возраст больных колебался от 29 до 78 лет, составив в среднем 55 лет. Преобладающей локализацией опухоли были нижняя (61%) и средняя (26%) трети желудка. У половины больных опухоли имели размеры до 2 см, в том числе у 34 (23%) пациентов – менее 1 см. В то же время, у каждого десятого больного максимальный размер новообразования превышал 6 см, а у 9 (6%) больных – превышал 10 см. Среди макроскопических форм роста возвышающиеся и плоские опухоли встречались с одинаковой частотой (24% и 23%); углубленные или изъязвленные – почти в два раза чаще (44%). Инфильтративный рост (4 тип по классификации Borrmann) имел место у 14 больных и наблюдался статистически значимо чаще при прорастании опухолью подслизистого слоя: 13% и 3% соответственно (р=0,0456). Изучение морфологического строения показало, что в 56% наблюдений опухоли были представлены высоко- и умеренно дифференцированной аденокарциномой; в 44% – низкодифференцированной аденокарциномой, перстневидно-клеточным и недифференцированным раком. Мультицентрический рост опухоли является одним из основных аргументов противников выполнения экономных резекций и эндоскопического лечения раннего рака желудка. По данным различных авторов два и более очага опухолевого поражения наблюдаются у 4-17% больных (в среднем – у 7-8%), причем, как правило, в пределах одной анатомической области. В нашем исследовании у 5 (3%) больных были выявлены две опухоли в одном (4 случая) и различных (1 случай) отделах желудка.
Среди 149 больных в 60 (40%) случаях опухоль располагалась на уровне слизистого слоя стенки желудка, а в 89 (60%) случаях – прорастала подслизистый слой. Среди больных с инвазией только слизистой оболочки ни в одном случае не были обнаружены метастазы в лимфатические узлы; при прорастании опухолью подслизистого слоя регионарные метастазы были выявлены у 18 (20%) больных. Частота метастатического поражения регионарных лимфатических узлов при раннем раке желудка (рТ1) по данным различных авторов варьирует от 5,5% до 43%; при прорастании слизистого слоя – от 0% до 5%, при прорастании подслизистого слоя – от 9,6% до 26%. Количество пораженных лимфатических узлов в нашем исследовании варьировало от 1 до 7, и в среднем составило 2,7. Метастазы обнаруживали в следующих группах лимфатических узлов: малого сальника (11 больных), большого сальника (4), вдоль левой желудочной артерии (4), надпривратниковых (1), подпривратниковых (1). Таким образом, у большинства больных (п=14, 78%) метастазы локализовались только в перигастральных лимфатических узлах (N1 в соответствии с Японской классификацией рака желудка); в 4 случаях – в лимфатических узлах второго коллектора (N2). По данным различных авторов, метастазы в перигастральные лимфатические узлы обнаруживаются в 75-80% случаев и более; во втором лимфатическом коллекторе – в 20-25%; в более отдаленных (N3-4) – в единичных наблюдениях.
Локализация первичной опухоли оказывала существенное влияние на риск развития лимфогенных метастазов. Так, при локализации опухоли в нижней трети желудка метастазы в регионарные лимфатические узлы были обнаружены у 12% больных, а при локализации в средней, верхней третях и при тотальном поражении желудка – в 31% (различие статистически значимо, р=0,03). Наиболее часто метастазы имели место при тотальном поражении желудка – у 3 из 6 больных (50%). Локализация опухоли влияла и на количество пораженных лимфатических узлов. Так, если при локализации опухоли в нижней трети желудка наличие двух и более пораженных лимфатических узлов имело место у 2 из 7 больных (29%), то при локализации опухоли в более проксимально расположенных отделах – у 7 из 11 больных (64%). Многофакторный анализ с использованием метода логистической регрессии определил локализацию опухоли как независимый прогностический фактор лимфогенного метастазирования. Частота лимфогенного метастазирования закономерно росла с увеличением размера опухоли. В тех случаях, когда диаметр опухоли не превышал 2 см, метастазы в лимфатические узлы определялись у 11% больных; при размере опухоли от 2 до 4 см – у 18% больных; при размерах более 4 см – у 33% больных. Различие между группами «4 см» статистически значимо (р=0,05). При минимальном размере опухоли (≤1 см) метастаз в лимфатическом узле был обнаружен лишь в одном наблюдении. Закономерности метастатического поражения лимфатических узлов второго коллектора (зоны чревного ствола и его ветвей) в мировой литературе освещены явно недостаточно. В основном это объясняется тем, что их поражение наблюдается лишь у 1-3,5% больных ранним раком желудка, в том числе в 3-7% случаев при прорастании первичной опухолью подслизистого слоя и в единичных случаях при внутрислизистых опухолях. По данным Tsujitani и соавт., метастазы в лимфатические узлы второго эшелона имели место у 15 из 890 (1,7%) больных и только в тех случаях, когда опухоли были более 2 см в диаметре и имели углубленный характер роста. В наших наблюдениях метастазы в лимфатические узлы второго коллектора лимфооттока имели место у 4 из 156 (2,6%) больных ранним раком желудка, в том числе у 4,3% – при прорастании подслизистой оболочки. Однако какой-либо закономерности в их развитии проследить не удалось – размеры первичной опухоли варьировали от 0,8 до 6,5 см; тип роста был как приподнятый, так и углубленный; степень дифференцировки – G1 и G3.
Из 148 оперированных и выписанных из стационара больных умерли 47; 26 больных умерли от причин, не связанных с основным заболеванием; 5 больных умерли от метахронных злокачественных новообразований (рака легкого, рака яичников, рака ободочной кишки, рака мочевого пузыря и острого лейкоза). У 7 больных причина смерти не известна; 14 больных умерли от рецидива рака желудка; у большинства из них (12 больных) имели место гематогенные метастазы. Локо-регионарный рецидив был выявлен у 6 больных и только в 2 случаях – изолированный (оба больных были радикально оперированы, произведена экстирпация культи желудка). Длительность безрецидивного периода варьировала значительно: от 2-6 месяцев (4 больных) до 109-112 месяцев (2 больных).
Показатели общей 5-, 10- и 15-летней выживаемости всей исследуемой группы больных составили 78%, 64% and 48% соответственно; медиана выживаемости – 15 лет. Скорректированная по причине смерти выживаемость была статистически значимо выше (χ2=8,196; df=l; р=0,0042). Выявлены два фактора, статистически значимо снижающих оба вида выживаемости: прорастание опухолью подслизистого слоя стенки желудка и метастатическое поражение регионарных лимфатических узлов. По данным различных авторов, 5-летняя выживаемость при прорастании опухолью слизистого слоя составляет 91-94%, подслизистого слоя – 78-83%, при отсутствии метастазов в регионарные лимфатические узлы – 85-100%, при наличии метастазов в регионарные лимфатические узлы – 64-81%. Поскольку метастазы в лимфатические узлы наблюдались только при поражении опухолью подслизистого слоя, мы сравнили выживаемость больных в зависимости от глубины инвазии опухолью стенки желудка при отсутствии регионарных метастазов. Оказалось, что статистически значимые различия (в пользу опухолей в пределах слизистого слоя) сохраняются по критерию общей выживаемости (χ2=8,834; df=l; р=0,003) и отсутствуют по критерию скорректированной выживаемости (χ2=2,775; df=1; р=0,0958).
Нами не выявлено статистически значимых отличий в результатах лечения в зависимости от локализации, морфологического строения, размера и макроскопического типа роста опухоли, а также вида оперативного вмешательства. При прорастании опухоли в пределах слизистого слоя только один больной умер от морфологически подтвержденного рецидива – множественных гематогенных и перитонеальных метастазов через 112 месяцев после оперативного лечения. Принимая во внимание очень низкую вероятность лимфогенного метастазирования и хорошие отдаленные результаты (15-летняя общая выживаемость – 80%, скорректированная выживаемость – 93%) мы считаем, что субтотальная резекция с ограниченной (D1) лимфаденэктомией является адекватным хирургическим вмешательством. Определенные подгруппы больных (небольшие по размеру опухоли при отсутствии мультицентрического роста) могут рассматриваться как кандидаты для более консервативного лечения – выполнения сегментарных операций, а также эндоскопического удаления опухоли. Преимущество органосберегающего лечения очевидно – улучшение качества жизни, более полная медицинская, социальная и трудовая реабилитация больных.
Отдаленные результаты лечения больных при прорастании опухоли в подслизистый слой были значительно хуже, и связано это, в первую очередь, с метастатическим поражением лимфатических узлов. 5 из 18 (28%) больных, имевших регионарные метастазы, умерли от рецидива заболевания. Принимая во внимание больший размер, чаще выявляемую мультицентричность поражения, более высокую частоту лимфогенного метастазирования, включая поражение лимфатических узлов второго и даже третьего коллектора, мы считаем, что лечение опухолей с распространением на подслизистый слой должно быть таким же, как и более распространенных форм рака желудка. Небольшой размер и экзофитный рост опухоли не могут быть основанием для ограничения объема вмешательства, поскольку напрямую не коррелируют с глубиной инвазии и наличием метастазов в лимфатические узлы. Однако, остается неясным, способно ли расширение объема оперативного вмешательства улучшить отдаленные результаты лечения, поскольку причиной смерти большинства больных были отдаленные метастазы. Более того, мы наблюдали 5 больных, умерших от множественных гематогенных метастазов в течение первого года (через 2,3,4, 6 и 10 месяцев) после операции. Полученные нами данные о преобладании гематогенного пути метастазирования раннего рака желудка, а также о высокой частоте развития рецидивов после хирургического лечения опухолей с инвазией подслизистого слоя и наличием метастазов в регионарные лимфатические узлы соответствуют данным других исследователей. Это означает, что даже ранние опухоли желудка могут иметь высокую биологическую агрессивность, и отдаленные метастазы могут быть уже к моменту выполнения операции. Частота развития рецидивов у больных раком желудка рТ1N+ в нашем исследовании (5 из 18 больных) соответствует аналогичному показателю в работах Abe S. и соавт. и Kitamura К. и соавт., хотя японские авторы рутинно использовали расширенную лимфодиссекцию. В двух крупных европейских рандомизированных исследованиях также не было показано преимуществ расширенной (D2) лимфаденэктомии по сравнению с ограниченной (D1) при опухолях Т1.
В заключение следует отметить, что практически все аспекты проблемы раннего рака желудка (определение, клинико-морфологические характеристики, выбор адекватного метода лечения и его результаты, факторы прогноза) продолжают оставаться предметом полемики. Полученные нами данные убедительно демонстрируют, что так называемый “ранний”, “поверхностный”, “начальный” или “малый” рак желудка с распространением только в пределах слизистого или подслизистого слоев представляет собой весьма разнородную группу опухолей. Они значительно отличаются по морфологической форме, особенностям роста в пределах стенки желудка, потенции давать лимфогенные и гематогенные метастазы, и, соответственно, по прогнозу. Так, опухоли с поражением подслизистого слоя, по сравнению с расположенными только в пределах слизистого слоя, статистически значимо больше по размеру, чаще имеют низкую степень дифференцировки, мультицентрический рост, и, главное, значительно чаще метастазируют в регионарные лимфатические узлы. Очевидно, что закономерности лимфогенного метастазирования являются краеугольным камнем в дискуссии о выборе адекватного лечения раннего рака желудка. Опухоли, расположенные на уровне слизистой оболочки стенки желудка, наиболее полно отвечают понятию раннего рака, поскольку практически не метастазируют в лимфатические узлы. Поэтому органосохраняющее лечение у данной категории больных может рассматриваться как адекватное с онкологических позиций. При прорастании опухолью подслизистого слоя, частота лимфогенных метастазов достигает 20-25%, а с учетом наличия микрометастазов повышается еще более. Дальнейший прогресс в лечении больных ранним раком желудка связан с индивидуализацией объема оперативного вмешательства на пораженном органе и лимфатическом аппарате. В последние годы появились позитивные результаты исследований, посвященных применению концепции сторожевых лимфатических узлов у больных раком желудка, что впервые открывает возможность индивидуальной оценки состояния регионарных лимфатических узлов. Проведенные исследования показали, что общая диагностическая точность оценки статуса регионарных лимфатических узлов на основании биопсии сторожевых лимфатических узлов весьма высока и составляет 90-98%. Интраоперационное (в том числе во время лапароскопического вмешательства) морфологическое исследование сторожевых лимфатических узлов может позволить обоснованно отобрать группу больных ранним раком желудка, у которых отсутствуют регионарные метастазы, для выполнения органосберегающих оперативных вмешательств. По нашему мнению, в настоящее время методом оперативного лечения рака желудка с распространением на подслизистый слой должна быть гастрэктомия либо дистальная субтотальная резекция желудка с модифицированной D2 лимфодиссекцией – удалением лимфатических узлов вдоль чревной, левой желудочной, общей печеночной и проксимальной части селезеночной артерии, и сохранением селезенки и поджелудочной железы.
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Источник
