Смывы при раке желудка
Рак желудка – это четвертое по частоте онкологическое
заболевание в мире с общей пятилетней выживаемостью 25%. Из-за высокой агрессивности
опухоли, большая доля пациентов сталкивается с перитонеальным канцероматозом.
Он развивается у 40% пациентов – практически у каждого второго, и связан с
плохим прогнозом – пятилетняя выживаемость составляет не более 5%. Средняя
продолжительность жизни при этом составляет около 6 месяцев.
При выявлении рака желудка, канцероматоз брюшины
обнаруживается у 5-20% пациентов. И хотя хирургия является стандартом лечения
пациентов с раком желудка, выявление опухолевых очагов на брюшине ставит под
сомнение целесообразность операции.
Для улучшения результатов лечения были предложены несколько
опций – циторедуктивная хирургия + HIPEC, неоадъювантная химиотерапия (до операции),
интраперитонеальная химиотерапия.
Прежде чем перейти к возможностям лечения, я хочу остановиться на причинах
развития канцероматоза брюшины при раке желудка.
Для объяснения распространения опухолевых клеток по брюшине
и их разрастании в перитонеальные метастазы, была предложена следующая теория.
Существует 3 основных пути:
- Опухоль распространяется на серозную (внешнюю) оболочку желудка. В таких случаях раковые клетки могут отделяться спонтанно, либо в результате хирургической травмы. Японскими исследователями было показано, что при изначально отрицательных результатам, опухолевые клетки появляются в брюшной полости после операции примерно в половине случаев.
- Во многих случаях рак желудка распространяется по лимфатическим путям. Именно поэтому во время операции обязательно выполняется лимфодиссекция – удаляются лимфоузлы, потенциально содержащие метастазы. Пересечение лимфатических сосудов может приводить к излитию лимфы и опухолевых клеток в брюшную полость
- Другой путь распространения рака желудка – через кровь. Большая кровопотеря во время операции ухудшает отдаленные результаты
Циторедуктивная хирургия и HIPEC при канцероматозе рака желудка
На сегодняшний день существует несколько исследований и
центров, в котором практикуется подобная стратегия лечения. К сожалению, эти
данные получены у пациентов с небольшим распространением опухоли и заведомо
более благоприятным прогнозом. Поэтому они не могут быть применены ко всем
пациентам с раком желудка, страдающим канцероматозом брюшины.
Но положительный момент в том, что отобранные пациенты могут
получить преимущества от такого подхода. В исследованиях показано, что в
среднем пациенты живут дольше – 15 месяцев. При этом каждый пятый пациент живет
5 лет и дольше. Основными условиями успешного лечения является низкий индекс
перитонеального канцероматоза – опухолевые импланты обнаруживаются только в
небольшом количестве участков брюшной полости, и выполненная полная
циторедукция – опухолевые очаги отсутствуют после проведенной операции не
обнаруживаются. Остаточная опухоль в брюшной полости резко ухудшает прогноз –
пациенты живут 6-8 месяцев, поэтому операция не приносит эффекта.
 Сколько живут пациенты с канцероматозом при раке желудка в случае полной циторедукции (синяя линия), остаточных опухолях менее 2.5 мм (желтая), более 2.5 мм — красная линия. По горизонтальной оси — продолжитьельность жизни в годах. По вертикальной — доля пациентов, которые живы в определенный момент времени
Сколько живут пациенты с канцероматозом при раке желудка в случае полной циторедукции (синяя линия), остаточных опухолях менее 2.5 мм (желтая), более 2.5 мм — красная линия. По горизонтальной оси — продолжитьельность жизни в годах. По вертикальной — доля пациентов, которые живы в определенный момент времени
Внутрибрюшная химиотерапия при раке желудка
Большинство исследований в этой области были проведены в странах Азии. В них сравнивались эффективность добавления внутрибрюшной химиотерапии после операции и HIPEC по сравнению только с операцией и HIPEC. Анализ этих исследований не показывает улучшения общей выживаемости у пациентов, которым добавлялась интраперитонеальная химиотерапия. При этом чаще возникают осложнения – нейтропения (снижение количества лейкоцитов) и абсцессы в брюшной полости (отграниченные скопления гноя, требующие активного лечения и потенциально угрожающие жизни).
Рак желудка с позитивными смывами из брюшной полости
Во многих ведущих центрах в России и в мире обязательным
этапом перед операцией при раке желудка является взятие смывов из брюшной
полости. Этот анализ проводится во время лапароскопии и под наркозом. Бывает,
что опухолевые клетки обнаруживаются при отсутствии канцероматоза брюшины. Этот
факт говорит о плохом прогнозе – такие пациенты живут в среднем столько же,
сколько пациенты с канцероматозом брюшины. Из-за этого тактика лечения таких
пациентов может отличаться – в некоторых центрах не рассматривают операцию,
т.к. удаление желудка ухудшает качество жизни и переносимость химиотерапии. В
других клиниках проводят предоперационную химиотерапию, а затем операцию –
удаление желудка и HIPEC.
Существующие на сегодня данные говорят в пользу операции и HIPEC – такие пациенты живут дольше.
В заключение хотелось бы сказать, что стандартом лечения при
канцероматозе рака желудка остается системная химиотерапия. Операции,
внутрибрюшная химиотерапия и HIPEC остаются экспериментальными опциями, которые могут помочь
только некоторым пациентам. Окончательно решение о выборе той или иной
стратегии лечения должен принять пациент совместно с докторам, взвесив все «за»
и «против».
Источник
Исследование на онкомаркеры
Диагностировать рак желудка без применения сложных и не всегда легко переносимых исследований, к сожалению, пока невозможно. Хотя распространённой практикой «диспансеризации» уже стало исследование онкомаркеров. К сожалению, этот метод трудно отнести к высокочувствительным (чувствительность этих тестов не превышает 50%). И все же повышение значений СА 72-4, РЭА, СА 19-9 служит сигналом к обязательному углубленному обследованию и исследованию увеличенного показателя в динамике.
Большее значение онкомаркеры имеют при оценке распространенности процесса и при возникновении рецидива заболевания после успешного лечения.
Симптомы
Для ранних стадий рака желудка характерно обилие паранеопластических симптомов, часто маскирующих развитие опухоли и уводящих в сторону от правильного диагноза.
- Один из самых ярких симптомов — черный акантоз, при котором развивается сопровождающаяся ворсинчато-бородавчатыми разрастаниями темная пигментация кожи подмышечных впадин и других крупных кожных складок. Иногда черный акантоз на несколько лет опережает проявления самой опухоли.
- Полимиозит, дерматомиозит, кольцевидная эритема, пемфигоид, не уступающий лечению тяжелый себорейный кератоз также требуют углубленного обследования с обязательным проведением эндоскопии желудка.
- Бывают случаи, когда выработка клетками опухоли глюкокортикоидных гормонов, которые в норме синтезируются надпочечниками, вызывает даже формирование т.н. эктопического синдрома Кушинга. При нем жировая ткань откладывается преимущественно на лице и животе (так называемый матронизм), повышается артериальное давление, развивается склонность к переломам костей и акне.
- Частым паранеопластическим проявлением рака желудка, впрочем, как и многих других опухолей является мигрирующий тромбофлебит (синдром Труссо).
- Тяжелее всего заподозрить развитие рака желудка, когда у пожилых людей вдруг начинает быстро прогрессировать деменция, или появляются нарушение координации движений, изменение походки, нарушение равновесия.

Ситуация усугубляется сходством клинической, рентгенологической и эндоскопической картины при изъязвленных опухолях и язвенной болезни. Поэтому самым чувствительным способом диагностики считается эзофагогастродуоденоскопия (ЭГДС, гастроскопия) с множественной биопсией, обязательной у пациентов, относящихся к группе риска. ЭГДС позволяет одновременно:
- выполнить биопсию и провести дальнейшее гистологическое и цитологическое исследование с целью морфологической верификации новообразования и диагностики;
- осуществить лечебные манипуляции по коагуляции полипа с его удалением при небольших размерах (до 2 см);
- остановить кровотечение;
- провести зонд для кормления и т.д.
При угрозе кровотечения используется менее травмирующая браш-биопсия. В сомнительных случаях назначают повторную биопсию через 8-12 недель. Но даже этот способ диагностики дает правильный ответ только в 90% случаев и может дать ложно отрицательный результат при инфильтративном росте опухоли (такой рак называют скирр).
Кроме рака в желудке могут развиваться и опухоли из других клеток, требующие совершенно иных подходов к лечению (саркома, лимфома). Единственный способ разобраться в этом — множественные биопсии при проведении ЭГДС. Для выявления измененных участков тканей, не обнаруживаемых при обычном осмотре, используют т.н. хромогастроскопию. Этот метод позволяет проводить диагностику опухолей на ранних стадиях благодаря тому, что при окрашивании слизистой оболочки желудка по время процедуры специальными красителями (конго-рот/метиленовым синим, индигокамином) и даже раствором Люголя опухолевые ткани выглядят иначе, чем здоровые.
Когда необходимо проведение ЭГДС (гастроскопии)?
Существуют заболевания, считающиеся предраковыми, при которых необходимо периодическое обследование независимо от наличия симптомов. К ним относят:
- хронический атрофический гастрит с т.н. кишечной метаплазией особенно при наличии хеликобактерной инфекции;
- язвенная болезнь желудка;
- пищевод Баррета;
- дефицит витамина В12 (пернициозная анемия);
- аденоматозные полипы желудка;
- гипертрофическая гастропатия.
Операции на желудке в связи с доброкачественными новообразованиями, перенесенные более 10-лет назад, и отягощенная наследственность также относятся к ситуациям, требующим пристального наблюдения.
Вы должны регулярно наблюдаться с обязательным регулярным проведением ЭГДС, если у ваших родственников диагностировались:
- рак органов желудочно-кишечного тракта,
- семейный аденоматозный полипоз толстой кишки,
- синдром Гарднера,
- синдром Пейтца-Егерса,
- семейный ювенильный полипоз,
- синдром Ли Фраумени.
С развитием генетики стали известны некоторые гены, определенные мутации которых при особых условиях приводят к раку желудка.
Существуют и регионы, в которых, видимо в результате особенностей питания или экологии, заболеваемость существенно выше средних показателей (Япония, некоторые страны Европы, Скандинавия, Южная и Центральная Америка, Китай, Корея, страны бывшего СССР). Людям, длительно живущим в этих районах, надо внимательнее относиться к своему здоровью и периодически проводить ЭГДС. Сигналом к обязательному обследованию может послужить такой показатель как концентрация пепсиногена сыворотки крови (в норме — меньше 70 нг/мл) и соотношение его фракций (ПГ1/ПГ2).
При невозможности проведения ЭГДС, например, из-за сопутствующих заболеваний, может быть проведена полипозиционная рентгенография с двойным контрастированием бариевой взвесью и воздухом. Этот метод обладает, правда, гораздо меньшей чувствительностью при ранних стадиях заболевания и не дает возможности морфологической верификации. Дополнительно используют МСКТ и УЗИ, однако точность последнего исследования даже при опытном исследователе очень зависит от технических возможностей аппарата, особенностей телосложения и правильности подготовки пациента.
Лапароскопическая диагностика желудка
При подозрении на распространение опухоли по брюшной полости возможно проведение диагностической лапароскопии и лапароскопического УЗИ, позволяющих подробно изучить процесс в непосредственной близости.
Этот метод позволяет осмотреть поверхности печени, передней стенки желудка, париетальной (выстилающей стенки брюшной полости) и висцеральной (покрывающей органы) брюшины с проведением при необходимости биопсии. В некоторых случаях эти данные принципиально важны для выбора лечения.

Прогноз при раке желудка
Прогноз зависит от количества пораженных лимфатических узлов и уровня поражения лимфатических коллекторов, глубины прорастания опухоли в стенку желудка, стадии процесса, типа роста и типа самой опухоли. По данным МНИОИ им. П.А.Герцена 5-летняя выживаемость при диагностике рака желудка на ранней стадии и быстро начатом лечении достигает 85-90%. В случае более позднего выявления ещё резектабельной опухоли — 11-54%, и даже в случае выявления рака на IV стадии лечение позволяет обеспечить 7% выживаемость больных в течение 5 лет.
Цены в Европейской клинике на диагностику рака желудка
- ЭДГС высокой четкости с цифровой записью, диагностическая — от 14300 руб.
- Рентгеноконтрастное исследование пищевода и желудка — 20700 руб.
- Ультразвуковое исследование брюшной полости (печень, желчный пузырь, желчные протоки, селезенка, поджелудочная железа), в т. ч. с определением уровня свободной жидкости — 7000 руб.
- Диагностическая лапароскопия — 57500 руб.
Но речь ведь не только о продлении жизни. Цель лечения в большинстве даже далеко зашедших случаев в улучшении её качества, избавлении человека от множества тягостных симптомов, в том числе болей, обеспечении ему возможности вести обычный образ жизни, заниматься важными для него делами, общаться с близкими.
Современные методы лечения рака желудка, применяемые в Европейской клинике, позволяют проводить лечение с минимальными сроками госпитализации и использованием малоинвазивных методик, улучшающих не только прогноз для жизни, но и качество самой жизни наших пациентов.
Источник
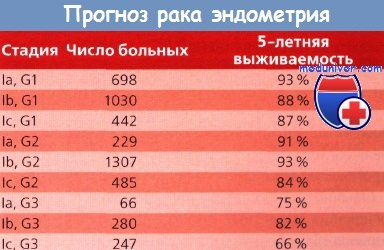
Цитология смывов брюшной полости при раке эндометрия и ее прогноз
Цитологическое исследование перитонеальной жидкости и смывов из брюшной полости определяет не только прогноз, но и стадию заболевания при злокачественных новообразованиях таза. По данным Creasman и Rutledge, у 12% больных раком эндометрия (РЭ) результат этого исследования положительный, у многих из них процесс принимает метастатический характер.
Из 167 пациенток с клинически установленным раком эндометрия (РЭ) I стадии, которым провели хирургическое лечение, злокачественные клетки в смывах были обнаружены у 26 (15,5%). Заболевание рецидивировало у 10 (38 %) из этих 26 больных по сравнению с 14 (9,9 %) из 141 с отрицательным результатом исследования смывов. При ревизии органов брюшной полости во время операции было выявлено, что из 26 пациенток с положительным результатом цитологического исследования у 13 (50 %) заболевание распространилось за пределы матки; 7 (54 %) из них умерли из-за прогрессирования заболевания.
У других 13 больных со злокачественными клетками в смывах процесс не распространялся за пределы матки; впоследствии 6 (46 %) из нихумерли по причине диссеминированного канцероматоза органов брюшной полости. В исследовании GOG, включавшем 621 пациентку, у 76(12 %) при цитологическом исследовании смывов из брюшной полости обнаружены злокачественные клетки.
Из них у 25 % имелись метастазы в лимфоузлах таза по сравнению с 7 % у женщин с отрицательным результатом исследования. Надо признать, что положительный результат цитологического теста на злокачественные клетки в смывах из брюшной полости в определенной степени согласуется с другими известными факторами прогноза, которые можно идентифицировать.
Обычно возникновение рецидивов определяют на основании известных прогностических факторов, включая данные цитологического исследования перитонеальных образцов. В случае отрицательного результата роль известных прогностических факторов остается неизменной, а в случае положительного — влияние благоприятных прогностических факторов нивелируется и ведущее значение приобретают цитологические находки.
Тем не менее Yazigi и соавт. утверждают, что цитологическое исследование смывов из брюшной полости не имеет прогностического значения. Данное исследование отражает результаты обследования и лечения больных РЭ 20 лет назад, когда такой анализ не выполняли, а ориентировались на данные только гистологического исследования. В исходной работе этих авторов многие больные были исключены из выборки по причине отсутствия морфологической документации патологического процесса. Konski и соавт. также не выявили различий в показателях выживаемости в зависимости от результатов цитологического исследования.
Однако в наблюдении этих авторов значительное количество пациенток после хирургического лечения получили ЛТ, которая могла повлиять на изучаемые показатели.
Позднее Sutton, используя многофакторный анализ, установил, что положительные результаты цитологического исследования перитонеальиых смывов — важный прогностический фактор. По данным GOG, у 25 (29%) из 86 больных с обнаруженными злокачественными клетками в промывных водах из брюшной полости наблюдались регионарные рецидивы заболевания или отдаленные метастазы по сравнению с 64 (10,4%) из 611 случаев с отрицательным результатом. Поданным ретроспективного исследования M.D. Anderson Hospital, злокачественные клетки в смывах из брюшной полости обнаружены у 28 (5 %) из 567 пациенток, при этом установлена корреляция со значительным укорочением безрецидивного периода и выживаемостью.
По данным многофакторного анализа у 477 пациенток, результат цитологического исследования был тесно связан с показателем выживаемости и продолжительностью периода без признаков прогрессирования. Grimshaw и соавт. обратили внимание на то, что из 381 больной раком эндометрия (РЭ) выживаемость 24 с положительными результатами цитологического исследования была значительно хуже, чем при отрицательных. Когда сравнили только пациенток с I хирургической стадией заболевания, то при отрицательном заключении цитологического исследования перитонеальных смывов прогноз был более благоприятным, но различие в показателях выживаемости не было статистически значимым.
Lo и соавт., сравнив выживаемость больных раком эндометрия (РЭ) I стадии с положительными (18 женщин) и отрицательными (127 женщин) результатами цитологического исследования, пришли к выводу, что рассматриваемый показатель не зависит от цитологических находок, но только при условии, если опухоль ограничена пределами матки.
Значение цитологического выявления злокачественных клеток в перитонеальных смывах для прогноза рака эндометрия (РЭ) продолжает оставаться предметом дискуссий. Исследования, обнаружившие минимальную эффективность метода или ее отсутствие, обычно охватывали ограниченное число больных раком эндометрия (РЭ) по сравнению с теми, у кого была установлена его прогностическая значимость.
Milosevic и соавт. провели обзор 17 исследований и подсчитали, что у 11 % из 3820 пациенток результаты теста были положительными. Результаты 3 самых круппых исследований (Harming, Turner, Morrow и соавт.), основанные на многофакторном анализе и охватывающие более 1700 больных раком эндометрия (РЭ), свидетельствуют о том, что наличие злокачественных клеток в смывах из брюшной полости — независимый прогностический фактор возникновения рецидивов и низкой выживаемости. Относительный риск рецидивов для всех больных составил 4,7 (ДИ 3,5— 6,3). В каждой из 3 работ установлена корреляция между положительным перитонеальным цитологическим тестом и распространением заболевания за пределы матки.
По данным многофакторного анализа, оказалось, что наличие клеток злокачественной опухоли в перитонеальных смывах остается важным прогностическим фактором даже в том случае, когда заболевание ограничено только маткой. До настоящего времени не определена оптимальная схема лечения рака эндометрия (РЭ) в случаях положительного результата этого анализа. Однако, поданным одного нерандомизированного исследования, использование интраперитонеального введения 32Р улучшает течение заболевания у больных раком эндометрия (РЭ) с опухолевыми клетками, обнаруженными в брюшной полости. Soper дополнил данные Университета Duke об использовании ;ИР у 65 больных раком эндометрия (РЭ), из которых у 53 клинически определена I стадия.
Безрецидивная выживаемость более 24 мес. равнялась 89 % у больных с I клинической стадией заболевания и 94 % — с I патоморфологической (хирургической) стадией. Каких-либо тяжелых острых и отдаленных осложнений не наблюдали, за исключением случаев, когда внутрибрюшное введение 32Р сочетали с дистанционной лучевой терапией (ДЛТ). Эта лечебная методика идентична применяемой при РЯ. Во время лапаротомии определяют объем перитонеальной жидкости, скопившейся в тазу. Если она отсутствует, то в полость таза вводят 100 — 125 мл обычного физиологического раствора. Это легко осуществимо с помощью ирригационного шприца. Затем физиологический раствор отсасывают шприцем и направляют на цитологическое исследование. Эту процедуру проводят всем больным, которых оперируют по поводу рака эндометрия (РЭ).
Классификация стадий рака эндометрия

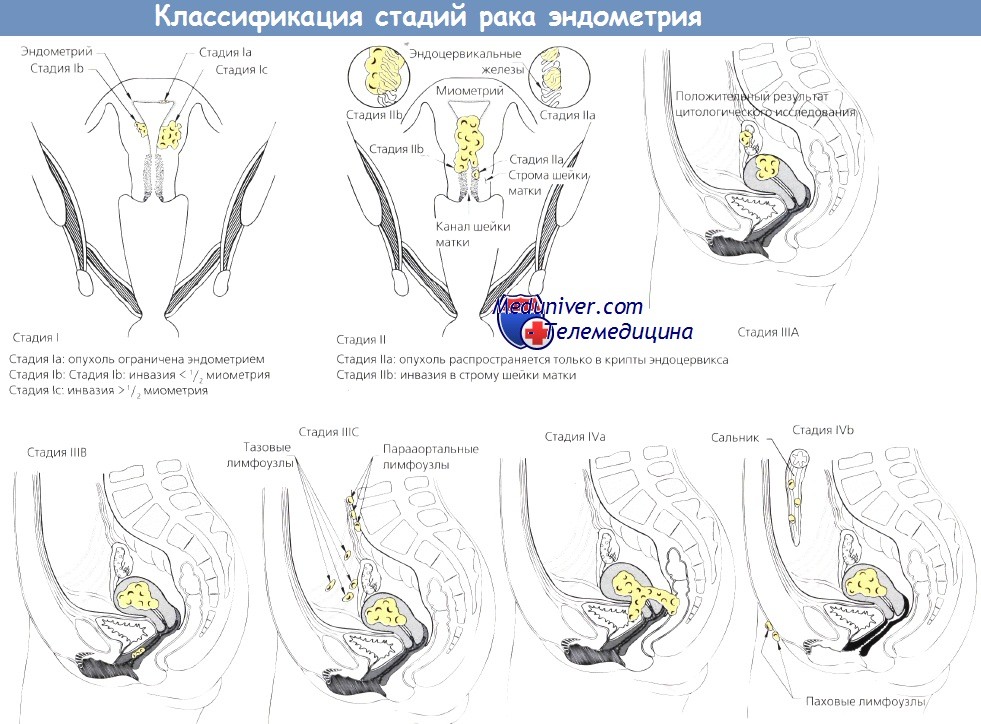
– Также рекомендуем “Метастазирование рака эндометрия в лимфоузлы и ее прогноз”
Оглавление темы “Аденокарцинома матки”:
- Секреторная аденокарцинома эндометрия
- Степень дифференцировки рака эндометрия и ее прогноз
- Стадии рака эндометрия и их прогноз
- Инвазия рака эндометрия в миометрий и ее прогноз
- Цитология смывов брюшной полости при раке эндометрия и ее прогноз
- Метастазирование рака эндометрия в лимфоузлы и ее прогноз
- Метастазирование рака эндометрия в придатки матки и ее прогноз
- Молекулярные маркеры рака эндометрия и ее прогноз
- Прогностические факторы рака эндометрия
- Лечение рака эндометрия и ее эффективность
Источник
